


1、余金權教授課題組Science:環烷烴羧酸的對映選擇性遠端亞甲基C-H(雜)芳基化
圖片來源:Science
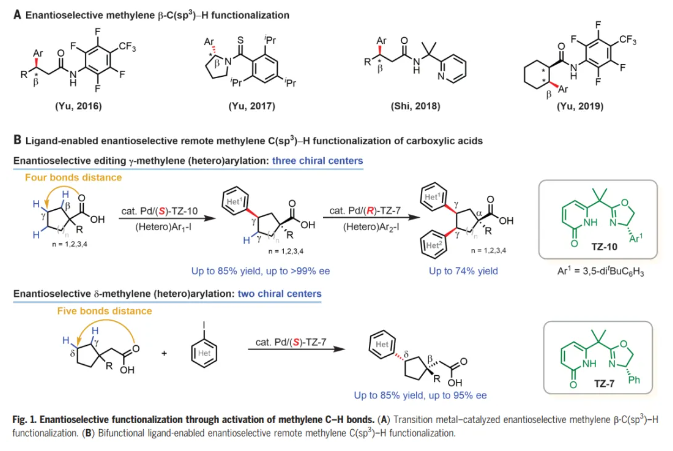
過渡金屬催化的對映選擇性C-H活化反應已成為一種強大且通用的方法,用于不對稱合成點、軸和平面手性的分子。在手性雙功能單N保護氨基酸(MPAA)配體及相關手性配體下,通過選擇性活化其中一個甲基以及亞甲基的直接不對稱活化,可實現偕二甲基的去對稱化。然而,除了環丙基和環丁基底物之外,對映選擇性亞甲基C-H活化方法仍然僅限于含有更強的外源導向基的底物。此外,這些方法僅限于近端手性中心距導向原子最多三個鍵的底物(Fig. 1A)。考慮到大多數生物活性天然產物和藥物分子都含有碳環,這有利于限制構象靈活性,從而改善ADME特性,如口服生物利用度,而多功能環烷烴羧酸起始原料的γ-和δ-C-H官能團化對于合成富含sp3碳的生物活性分子特別有價值。在這里,作者發展了手性雙功能噁唑啉-吡啶酮配體,其能夠實現多種無環羧酸的對映選擇性遠程γ-C-H(雜)芳基化,構建γ-叔碳手性中心,同時α-季碳中心去對稱化高達>99% ee,為各種環狀手性合成子和生物活性分子提供了高度對映選擇性途徑。通過使用具有相反構型的手性配體在這些空間擁擠的碳環中構建第三個手性中心,證明了兩個亞甲基C-H鍵的順序對映選擇性編輯。手性Pd/噁唑啉-吡啶酮催化劑還能夠進行對映選擇性δ-C-H(雜)芳基化(Fig. 1B)。化學加——科學家創業合伙人,歡迎下載化學加APP關注。
選擇性地形成羰基α-、β-、γ-和δ-位手性中心的反應是不對稱有機合成中最理想和最通用的轉化之一。化學家們已經報道了許多能夠高選擇性構建α-和β-手性中心的對映選擇性反應。相比之下,催化對映選擇性形成羰基的γ-和δ-手性中心仍然極具挑戰。受作者之前通過C-H活化構建α-和β-手性中心以及開發碳環外消旋γ-C-H 芳基化的成功的鼓舞(Science, 2018, DOI: 10.1126/science.aao4798;Nature, 2023, 618, 519-525),余金權團隊尋求開發能夠對映選擇性遠程催化γ-和δ-C-H功能化的手性Pd催化劑,有望解決這一未滿足的需求。
圖片來源:Science
鑒于環系統在有機化學中的重要性,選擇1-丙基環戊烷-1-羧酸(1a)和4-碘苯甲酸甲酯(2z)作為反應開發和配體設計的模型底物。手性吡啶酮-磺酰胺配體(L7)和聯萘酚衍生的吡啶-吡啶酮配體(L8)以中等產率(45%-57%)提供所需的芳基化產物,表明吡啶酮單元對于激活亞甲基 C-H鍵至關重要。作者合成了一系列手性雙功能噁唑啉-吡啶酮配體,它們可以作為五元(TZ-1至4)或六元(TZ-5至12)螯合物與Pd(II)配位,事實證明,六元螯合物(TZ-5 至 12)則提供中等至良好的產率。噁唑啉環上芳基取代基的存對于在該反應中獲得立體控制至關重要,芳基化類似物(TZ-7至10)提供具有優異水平對映選擇性(85-97%ee)的γ-芳基化產物。經過對反應的廣泛優化,六元螯合噁唑啉-吡啶酮配體 TZ-10被確定為最佳配體,形成γ-芳基化產物,收率74%,ee 97%。
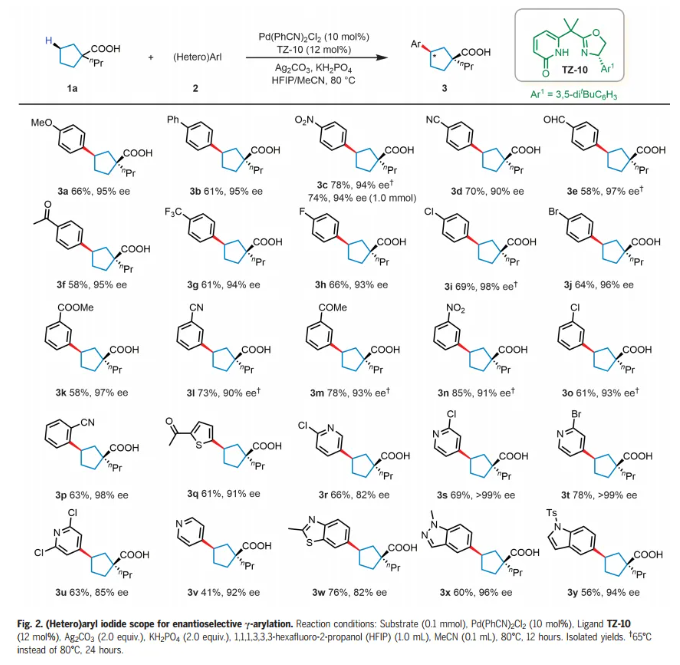
有了最佳的配體和條件,作者開始研究環戊基羧酸(1a)反應中芳基和雜芳基碘化物的范圍(Fig. 2)。芳基碘化物上的各種對位取代基,從給電子(OMe)到吸電子(包括NO2、CN和CF3)都是相容的,得到相應的γ-芳基化酸(3a-g),產率58%-78%,具有優異的對映選擇性(90%-97% ee),僅檢測到順式產物。還可以耐受鹵素取代基,如氟、氯、溴,以64-69%的產率和93-98% ee得到所需產物(3h-j)。帶有間位或鄰位取代基的芳基碘化物也表現良好,以中等至良好的產率和90%-98% ee形成所需產物。接下來考察了雜芳基化反應,多種2-取代雜芳基碘化物能夠以中等收率和優異的ee形成相應的產物。即使是4-碘吡啶,也能以41%的產率和92% ee提供相應的產物(3v)。

圖片來源:Science
接下來,作者研究了環烷羧酸的范圍(Fig. 3)。在羧酸的α-位帶有醚或酯官能團的各種烷基取代物是相容的,以40-74%的產率和83-97% ee 提供偶聯產物(4a-f)。羧酸α-位的芳基也可以耐受,提供36-54%產率和81-94% ee 的芳基化產物,質量平衡高于85%,其中環烷羧酸回收率為30-50%。市售的α-芳基環戊烷甲酸成功與雜芳基碘化物偶聯,生成了HDAC抑制劑前體(4i)及其新的類似物(4j),收率36-45%,ee 93-94%。與以前繁瑣的方法(十步,產率和手性分辨率較低)相比,本文的反應為合成這些藥物分子提供了一條顯著改進的途徑。六元環烷烴和雜環羧酸提供了具有中等到高對映選擇性的γ-芳基化產物(4k-1)。七(4m-n)和八(4o)元環也順利反應,提供了目標γ-芳基化產物,其ee率為99%。
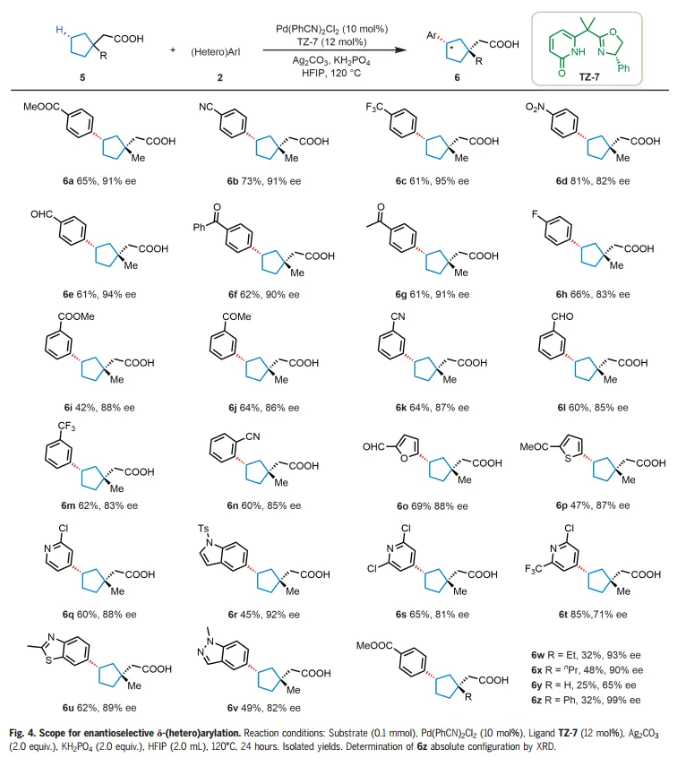
受到γ-亞甲基C-H芳基化結果的鼓舞,作者想知道這些手性雙功能噁唑啉-吡啶酮配體是否也可以實現更遠端δ-亞甲基C-H鍵的對映選擇性芳基化。選擇2-(1-甲基環戊基)乙酸(5a)與4-碘苯甲酸甲酯(2z)作為模型底物。通過對反應條件的廣泛優化,將產率提高到64%,同時保持91% ee,僅檢測到順式產物。接下來用底物5a來考察芳基和雜芳基碘化物的范圍(Fig. 4)。對位、間位和鄰位的各種不同官能團是兼容的,以中等至良好的產率(42%-81%)和82%-95% ee提供δ-芳基化產物(6a-n)。各種含有呋喃基、噻吩基、苯并噻唑基、吲哚基和吡啶基的雜芳基碘化物成功偶聯,得到所需產物(6o-v),收率45%-85%,ee 71%-92%。帶有β-乙基和β-丙基取代基的羧酸也表現良好,產物 (6w-x) 32%-48%的產率和90%-93% ee。這一單一操作同時在碳環上構建 β-季碳和δ-手性中心,而使用以前的方法很難完成這一任務。
圖片來源:Science
最近,構建1,2-二芳基取代的碳環的重要性在許多藥物發現項目中變得越來越明顯。作者設想了一種連續的對映選擇性C-H芳基化過程,該過程可以為制備多種1,2-芳基化碳環提供一種通用的方法(Fig. 5A)。通過具有相反構型的手性配體(R)-TZ-7,可以以30%-74%的產率獲得二次芳基化和雜芳基化產物(7a-d)。僅觀察到單一順式二芳基化非對映異構體。更具挑戰性的二雜芳基取代的碳環(7e)也以32%的產率制備。衍生自孕烯醇酮和半乳糖的芳基碘化物也是相容的,以64%-67%的產率提供所需的偶聯產物(8a-b),dr > 20:1(Fig. 5B)。

圖片來源:Science
2、Nuno Maulide課題組Science:遠程質子消除,通過遠端酸化實現 C-H 激活

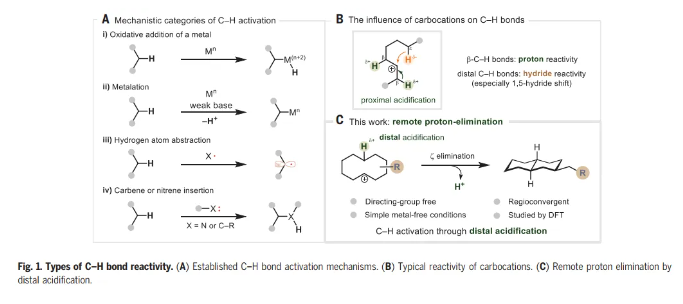
在過去的50年里,一系列的研究已經發現了許多能夠激活C-H鍵的化學系統,但是能夠激活C-H鍵裂解的基元步驟類型相對較少。當從機理的角度看待文獻主體時,只有四類C-H鍵激活涵蓋了大多數例子。這些包括(i)金屬的氧化加成,(ii)使用弱堿的定向金屬化,(iii) 氫原子提取,以及(iv)卡賓或者氮賓插入(Fig. 1A)。通過以前未探索的機制操作的C-H激活過程的識別可以被視為該領域持續發展的關鍵。 化學加——科學家創業合伙人,歡迎下載化學加APP關注。
圖片來源:Science
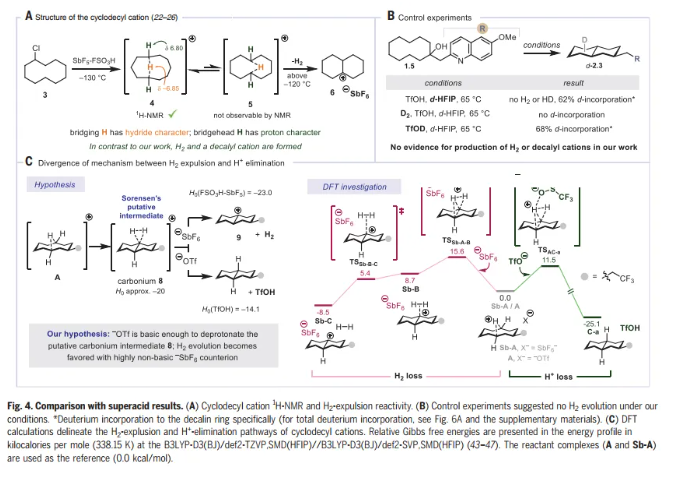
為了闡明C-H活化的不同模式,Nuno Maulide教授課題組報道了碳陽離子的遠程消除反應,導致C-C鍵的形成(Fig. 1C)。眾所周知的碳陽離子傾向于酸化近端β-C-H鍵,同時誘導遠端C-H鍵的氫化物反應性,而這一過程涉及相反的極化情況,即酸化遠端C-H鍵。環癸基碳陽離子的消去可以從預期的E1途徑(通過β-消去產生新的π-C=C鍵)轉移到涉及在五個鍵分隔的碳之間形成新的σ-C-C鍵的途徑(即ζ消去)。遠程消去被證明是合成十氫萘的有效策略,依賴于橋接C-C鍵的非典型逆合成斷開,而不是一個或多個非橋接鍵(如Robinson環化)。
文章的靈感來自于1955年Cope小組的一份報告,該報告描述了用2-萘磺酸處理反式環癸烯形成少量十氫萘。反應的主要產物是順-環癸烯,可能是由E1 β消除產生的。由于中環張力的減輕,十氫萘的形成在熱力學上應該是有利的,Cope的結果表明,動力學控制有利于β-消除。Nuno Maulide教授課題組推測β-消除在酸性條件下是可逆的,而遠程(ζ)消除是不可逆的。鑒于β-消除的可逆性,作者認為,可以確定一組熱力學條件來有選擇地促進ζ消除(Fig. 2A)。
這一評估被證明是正確的,并且能夠開發一套熱力學條件來選擇性地促進遠程消除,在65 °C下使用三氟甲磺酸(TfOH)與六氟異丙醇(HFIP)的組合(Fig. 2B)。傳統的無氟溶劑不如HFIP,這一效應在其他幾項涉及Br?nsted酸介導反應的研究中也觀察到了。在較低的溫度下(0 ℃為1.1),得到環癸烯的混合物,這種混合物在較高溫度下聚合成十氫萘產物2.1的單一區域異構體。在ζ消除之前觀察到一個非選擇性的β-消除途徑,給出單一的十氫萘區域異構體,表明區域收斂是在發揮作用。為了證實這一觀察結果,將異構體1-,2-和3-(2-皮考基)環癸烷-1-醇(分別為1.2,1.3和1.4)進行跨環ζ消除(Fig. 2C)。在所有情況下,decalins (2.2a-2.2c)的產率和比例相當,證實了假設的區域收斂性,并在syn-1.2和anti-1.2的情況下建立了立體收斂性。由于合成1.2、1.3和1.4的難易程度差異很大(1-取代1.4可以一步獲得),對于所提議的底物的合成完全失敗的情況,該方法的區域收斂性提供了使用底物的替代異構體作為后備。

圖片來源:Science
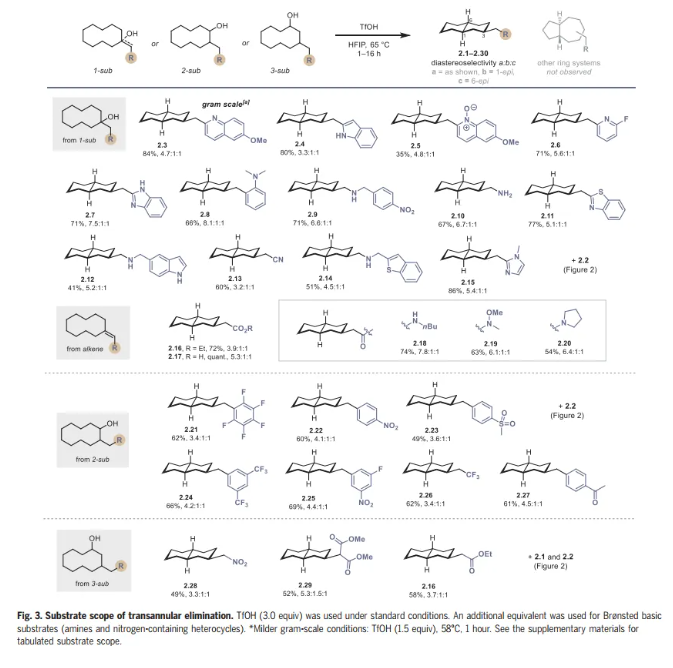
在這一點上,作者試圖徹底研究幾種1-、2-和3-取代環癸醇以及烯烴底物的遠程消除底物范圍(Fig. 3)。1-取代環癸醇(1)可以用最少的合成步驟制備,因此構成了本文研究的大部分。作者發現底物上的缺電子和富電子雜環取代基適合跨環消除,可獲得吡啶取代(2.2,2.6)、喹啉取代(2.3,2.5)、吲哚取代(2.4)、苯并咪唑取代(2.7和2.15)和苯并噻唑取代(2.11)十氫萘,產率優良。在研究早期,作者試圖建立該反應的合成可行性,以克為單位制備喹啉2.3,采用較溫和的條件(1.5當量的TfOH),并以84%的收率提供克級規模2.3。
氨基醇和烯烴也能兼容,提供2.9,2.10,2.12,2.14和2.16至2.20。使用2-取代環癸醇可以以良好的非對映選擇性高效制備2.21至2.27。最后,作者研究了3-取代環癸醇,得到2.28到2.30。該反應能同時形成三個立體中心,從而使起始原料的取代模式和相對立體化學與產物分離。在其他雙環異構體中,如5,7-稠合環系,觀察到十氫萘具有完全的選擇性。
圖片來源:Science
接著,作者進行了反應機理的研究。作者對環癸基陽離子在三氟甲磺酸酸鹽(-OTf, A)或六氟銻酸鹽(SbF6-,Sb-A)抗衡離子存在下的反應性進行了DFT計算(Fig. 4C)。在三氟甲磺酸鹽存在時觀察到H+的消除(產生十氫萘C-a)和在SbF6-存在時排出 (產生十氫萘陽離子Sb-C),兩者之間存在明顯的差異。結合實驗證據,可得出結論:遠端酸化是C-H活化的模式,支持觀察到的反應活性,抗衡離子在介導該反應中的關鍵作用。此外,DFT計算使作者能夠確定動力學選擇性是遠程消除的非對映選擇性和區域選擇性的主要決定因素。
圖片來源:Science
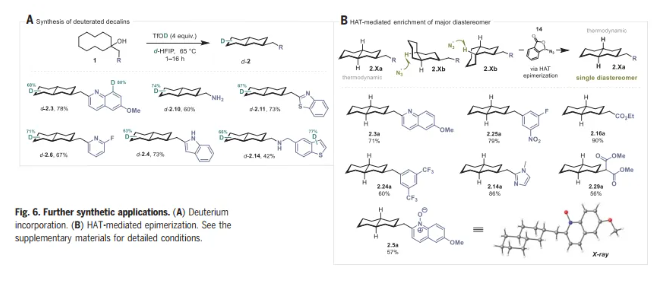
在本文的條件下,作者使用d-HFIP和TfOD,獲得了全氘代十氫萘,為合成氘代十氫萘提供了一種簡單而可靠的替代方案。最后,受陳弓教授等人的工作的啟發,作者研究了HAT介導的遠端C-H活化產物的差向異構化(Fig. 6B)。在BIN3, 14條件下,2.Xb順利發生差向異構化,得到熱力學穩定的異構體 2.Xa。
圖片來源:Science
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn