(圖片來源:Nat. Commun.)
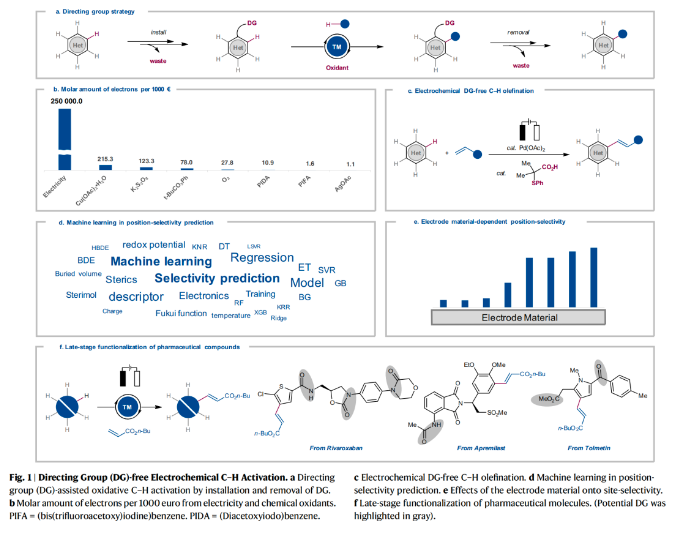
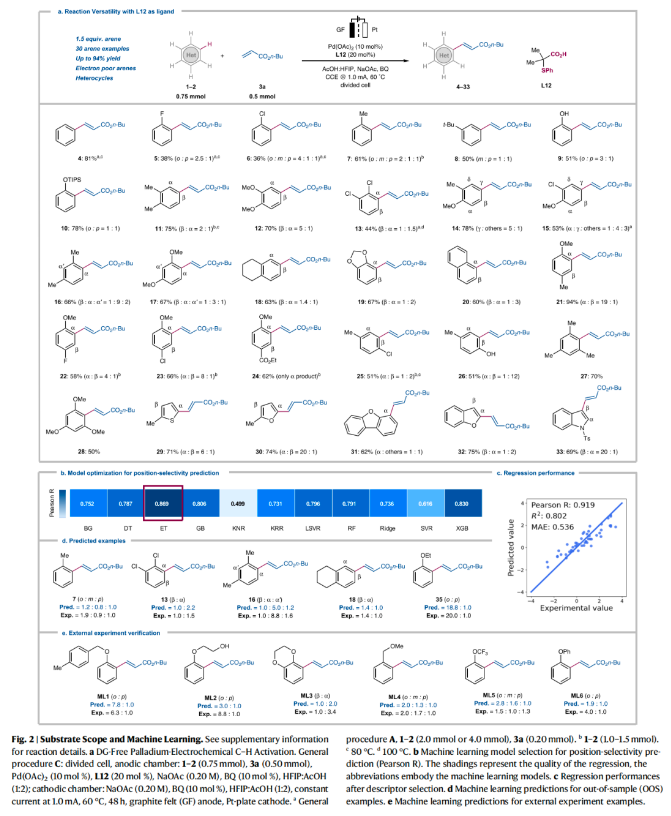
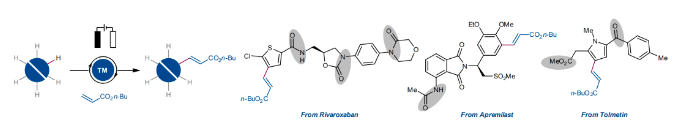
近些年,電氧化已經(jīng)作為一種重要的分子合成工具被化學(xué)家們廣泛使用,其可以在避免使用化學(xué)計(jì)量氧化還原試劑的條件下來實(shí)現(xiàn)分子編輯。盡管目前電化學(xué)C-H活化領(lǐng)域已經(jīng)取得了重大進(jìn)展,但通常需要導(dǎo)向基團(tuán)的參與來實(shí)現(xiàn)芳烴的C-H活化/官能團(tuán)化過程。而這些導(dǎo)向基團(tuán)的安裝和移除需要額外的合成步驟,從而導(dǎo)致步驟經(jīng)濟(jì)性和原子經(jīng)濟(jì)性的降低。最近,德國哥廷根大學(xué)Lutz Ackermann課題組與浙江大學(xué)洪鑫課題組聯(lián)合發(fā)展了在沒有外源導(dǎo)向基團(tuán)的存在下,鈀/電共催化簡單芳烴的C-H烯基化反應(yīng)。此策略在溫和的條件下即可以實(shí)現(xiàn)芳烴的C-H烯基化,從而避免了化學(xué)氧化劑的使用(Fig. 1)。下載化學(xué)加APP到你手機(jī),更加方便,更多收獲。 首先,作者以鄰二甲苯1h作為模板底物進(jìn)行反應(yīng)探索。通過一系列條件篩選,作者發(fā)現(xiàn)當(dāng)使用Pd(OAc)2 (10 mol%), L12 (20 mol%), NaOAc (0.20M), BQ (10 mol%), 在HFIP:AcOH (1:2)中,1.0 mA恒電流, 60 °C下反應(yīng)48 h可以以75%的分離產(chǎn)率得到C-H烯基化產(chǎn)物11(β : α = 2:1)(陽極:石墨氈;陰極:Pt)。控制實(shí)驗(yàn)表明,鈀催化劑、配體以及電流對此反應(yīng)過程至關(guān)重要,缺一不可。值得注意的是,當(dāng)在降低芳烴用量的情況下進(jìn)行放大量實(shí)驗(yàn)并不會降低反應(yīng)效率。在得到了最優(yōu)反應(yīng)條件后,作者對此轉(zhuǎn)化的底物范圍進(jìn)行了探索(Fig. 2)。實(shí)驗(yàn)結(jié)果表明,此轉(zhuǎn)化對一系列單取代芳烴、1,2-二取代芳烴、1,3-二取代芳烴等均可兼容,以良好的位點(diǎn)選擇性和反應(yīng)效率得到相應(yīng)的C-H烯基化產(chǎn)物4-33(36-94%)。值得注意的是此體系對鹵素、烷基、甲氧基、酯基、雜芳基(噻吩、呋喃、苯并呋喃)等一系列基團(tuán)均可兼容,展現(xiàn)了此體系的良好官能團(tuán)兼容性(Fig. 2a)。接下來,為了精準(zhǔn)預(yù)測反應(yīng)的位點(diǎn)選擇性,作者基于收集到的所有芳烴的位點(diǎn)選擇性數(shù)據(jù)建立了機(jī)器學(xué)習(xí)模型(Fig. 2b)。建立的Extra-Trees (ET)模型在位點(diǎn)選擇性預(yù)測中提供了最好的性能,所得到的機(jī)器學(xué)習(xí)模型顯示出較高的準(zhǔn)確性(R = 0.919;MAE (mean absolute error) = 0.536)(Fig. 2c)。特征重要性闡明了區(qū)域選擇性預(yù)測的決定因素,其中反應(yīng)位點(diǎn)的Fukui函數(shù)是最重要的參數(shù)。為了進(jìn)一步對此模型進(jìn)行驗(yàn)證,作者進(jìn)行了OOS(out-of-sample)預(yù)測。將部分芳烴的數(shù)據(jù)從集合中抽離,作者重新訓(xùn)練了模型并進(jìn)行目標(biāo)芳烴的預(yù)測,Fig. 2d展示了這些出色的OOS預(yù)測的幾個(gè)示例。受到此結(jié)果的鼓舞,作者進(jìn)一步用6種新的芳烴進(jìn)行了建模預(yù)測和實(shí)驗(yàn)驗(yàn)證。總的來說,作者建立的模型與實(shí)驗(yàn)觀測結(jié)果很好地吻合(Fig. 2e)。由此表明了此模型的預(yù)測潛力,可以有效減少實(shí)驗(yàn)優(yōu)化過程。接下來,作者研究了苯醚衍生物2和烯烴3在此電催化過程中的兼容性(Fig. 3)。實(shí)驗(yàn)結(jié)果表明,不同的苯醚衍生物均具有良好的兼容性,以41-55%的產(chǎn)率得到產(chǎn)物34-38。值得注意的是,此策略與文獻(xiàn)報(bào)道的策略(Nature, 2017, 551, 489; Org. Lett., 2012, 14, 1760)具有互補(bǔ)的位點(diǎn)選擇性(例如34和35)。此外,不同的烯烴,包括丙烯酸酯,丙烯酰胺、丙烯酸、烯基砜、烯基膦等均可兼容,以43-66%的產(chǎn)率高位點(diǎn)選擇性的得到相應(yīng)的C-H烯基化產(chǎn)物39-52(Fig. 3a)。為了對為C-H活化步驟有更深入的了解,作者進(jìn)行了理論計(jì)算。計(jì)算結(jié)果表明鄰位產(chǎn)物的形成在動力學(xué)和熱力學(xué)上均是有利的,其C-H活化能壘分別為9.7 kcal mol?1 (TS(1-2)ortho)和10.7 kcal mol?1 (TS(1-2)para)。TS(1-2)ortho中的非共價(jià)相互作用進(jìn)一步揭示了苯甲醚中的甲氧基與S,O-配體苯基部分之間存在弱穩(wěn)定相互作用,這有助于優(yōu)先形成鄰位產(chǎn)物(Fig. 3b)。為了進(jìn)一步理解苯醚類化合物的高位點(diǎn)選擇性來源,作者進(jìn)行了更深入的探索(Figs. 3c-g)。與常用化學(xué)氧化劑反應(yīng)條件相比,作者所發(fā)展的電化學(xué)反應(yīng)的位點(diǎn)選擇性有顯著改善(Fig. 3c)。作者通過對不同電極材料的探索發(fā)現(xiàn),電極材料與位點(diǎn)選擇性有顯著的相關(guān)性,從而將鄰位/對位選擇性從2:1提高至17:1(Fig. 3d)。而對于這種選擇性的急劇變化,作者利用時(shí)間分辨分析(time-resolved analysis)對其進(jìn)行了探索。在最初的12小時(shí)內(nèi),鄰位/對位選擇性的比率保持不變,隨后則發(fā)生了相當(dāng)大的變化,有利于鄰位官能團(tuán)化產(chǎn)物的生成。這一結(jié)果可以由隨后的烯烴選擇性電化學(xué)氧化僅發(fā)生在對位烯基化產(chǎn)物上來解釋。值得注意的是,第二次氧化是在烯烴3a完全消耗后才選擇性的發(fā)生(Fig. 3e)。隨后,作者將單獨(dú)制備的對位烯基化產(chǎn)物40在標(biāo)準(zhǔn)電化學(xué)條件下反應(yīng),并對產(chǎn)物進(jìn)行乙酰氧基化,可以以67%的產(chǎn)率得到雙乙酸酯產(chǎn)物40’,由此表明電在電氧化過程中起著重要作用(Fig. 3f)。接下來,作者通過CV實(shí)驗(yàn)表明,對位烯基化產(chǎn)物比鄰位烯基化產(chǎn)物更容易被氧化,這與實(shí)驗(yàn)結(jié)果很好地吻合(Fig. 3g)。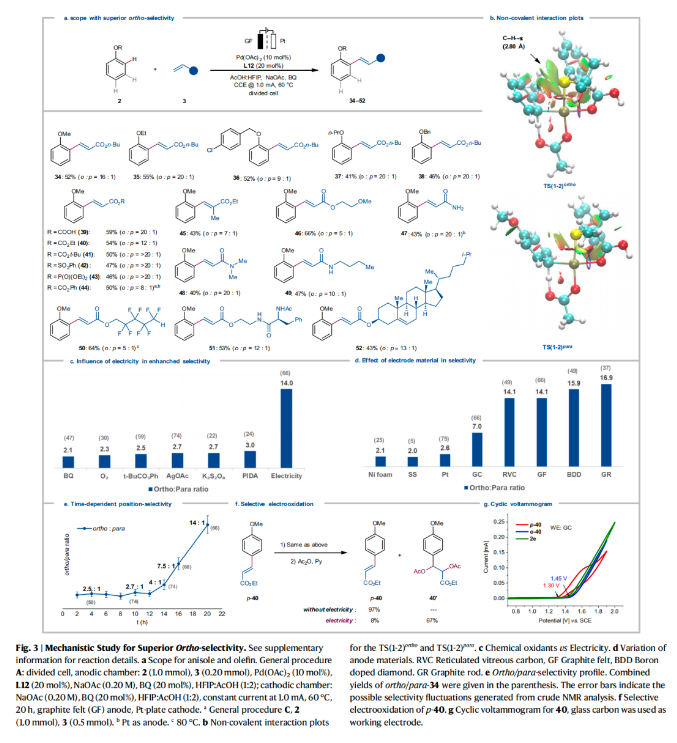 最后,為了證明此轉(zhuǎn)化的應(yīng)用性,作者利用所發(fā)展的無導(dǎo)向基團(tuán)電催化反應(yīng)策略,對生物相關(guān)藥物分子進(jìn)行后期官能團(tuán)化(LSF)(Fig. 4)。包括Tolmetin、Rivaroxaban、Bezafibrate、Gemfibrozil、Apremilast、Indomethacin、Naproxen、Ibuprofen、Ciprofibrate、Etodolac、Khellin、Trioxsalen、Etofenprox、Etofenprox等均可位點(diǎn)選擇性的實(shí)現(xiàn)C-H烯基化,以10-82%的產(chǎn)率得到相應(yīng)的產(chǎn)物54-69,證明了此轉(zhuǎn)化的實(shí)用性。Lutz Ackermann課題組與洪鑫課題組聯(lián)合報(bào)導(dǎo)了一種強(qiáng)大且通用的電化學(xué)烯基化策略,在不需要化學(xué)氧化劑的條件下,通過電流、電極和鈀催化劑的協(xié)同作用即可實(shí)現(xiàn)芳烴的烯基化。一系列不同取代的烯烴和芳烴均可兼容此體系,在不需要安裝和去除任何導(dǎo)向基團(tuán)的條件下即可實(shí)現(xiàn)C-H烯基化。詳細(xì)研究表明電流和電極材料在選擇性控制中起到了的關(guān)鍵作用。此外,作者還開發(fā)了機(jī)器學(xué)習(xí)模型來實(shí)現(xiàn)數(shù)據(jù)驅(qū)動的位點(diǎn)選擇性預(yù)測。生物活性藥物分子的后期衍生化證明了此策略的實(shí)用性。
最后,為了證明此轉(zhuǎn)化的應(yīng)用性,作者利用所發(fā)展的無導(dǎo)向基團(tuán)電催化反應(yīng)策略,對生物相關(guān)藥物分子進(jìn)行后期官能團(tuán)化(LSF)(Fig. 4)。包括Tolmetin、Rivaroxaban、Bezafibrate、Gemfibrozil、Apremilast、Indomethacin、Naproxen、Ibuprofen、Ciprofibrate、Etodolac、Khellin、Trioxsalen、Etofenprox、Etofenprox等均可位點(diǎn)選擇性的實(shí)現(xiàn)C-H烯基化,以10-82%的產(chǎn)率得到相應(yīng)的產(chǎn)物54-69,證明了此轉(zhuǎn)化的實(shí)用性。Lutz Ackermann課題組與洪鑫課題組聯(lián)合報(bào)導(dǎo)了一種強(qiáng)大且通用的電化學(xué)烯基化策略,在不需要化學(xué)氧化劑的條件下,通過電流、電極和鈀催化劑的協(xié)同作用即可實(shí)現(xiàn)芳烴的烯基化。一系列不同取代的烯烴和芳烴均可兼容此體系,在不需要安裝和去除任何導(dǎo)向基團(tuán)的條件下即可實(shí)現(xiàn)C-H烯基化。詳細(xì)研究表明電流和電極材料在選擇性控制中起到了的關(guān)鍵作用。此外,作者還開發(fā)了機(jī)器學(xué)習(xí)模型來實(shí)現(xiàn)數(shù)據(jù)驅(qū)動的位點(diǎn)選擇性預(yù)測。生物活性藥物分子的后期衍生化證明了此策略的實(shí)用性。文獻(xiàn)詳情:
Zhipeng Lin, Uttam Dhawa, Xiaoyan Hou, Max Surke, Binbin Yuan, Shu-Wen Li, Yan-Cheng Liou, Magnus J. Johansson, Li-Cheng Xu, Chen-Hang Chao, Xin Hong*, Lutz Ackermann*. Electrocatalyzed direct arene alkenylations without directing groups for selective late-stage drug diversification, Nat. Commun., 2023, https://doi.org/10.1038/s41467-023-39747-0.