


北京時間2021年9月27日,中國科學院上海藥物研究所李亞平課題組以“T lymphocyte membrane-decorated epigenetic nanoinducer of interferons for cancer immunotherapy”為題在國際頂級期刊Nature Nanotechnology在線發表了工程化T淋巴細胞膜修飾干擾素(IFN)表觀遺傳納米誘導劑改善腫瘤免疫治療的最新研究成果。該團隊創造性地設計構建了一種“精準遞送+智能釋藥一體化”的仿生納米囊泡,揭示了該納米遞藥系統的作用機理,取得了腫瘤特異性IFN誘導并同時克服免疫耐受的重大突破。
免疫療法是腫瘤治療領域的革命性進展,腫瘤內I型IFN的水平與包括結腸癌、黑色素瘤和三陰性乳腺癌等在內的多種腫瘤預后密切相關。雖然目前臨床上可以通過注射重組人IFN提高其瘤內水平,但其腫瘤靶向性差、療效低,而且易產生明顯的全身免疫毒性。化療藥物、分子靶向藥物以及表觀遺傳藥物雖然也能一定程度上誘導腫瘤內IFN表達,但由于特異性差,效果并不理想,特別是瘤內IFN的上調會不可避免地誘導多種免疫檢查點分子表達,促使腫瘤發生免疫逃逸進而產生免疫耐受。因此,如何選擇性提高瘤內IFN等免疫分子水平,并同時克服其誘導的免疫耐受,是腫瘤免疫治療領域亟待解決的一個重大科學問題。
針對上述臨床重大需求,上海藥物所張鵬程研究員、李亞平研究員團隊首先通過基因工程技術構建了高表達程序性死亡受體-1(PD1)的T細胞,并獲得該工程化細胞的膜囊;隨后用其包裹負載賴氨酸特異性組蛋白去甲基化酶1(LSD1)抑制劑ORY-1001的白蛋白納米粒; 最后以還原敏感穿膜肽M70對其進行表面修飾獲得表觀遺傳調控納米囊泡(OPEN)(圖1A)。靜脈注射后,OPEN通過受配體(PD1/PDL1)的識別,主動靶向遞送ORY-1001至表達PDL1的腫瘤細胞,在胞內谷光甘肽(GSH)的作用下快速釋放ORY-1001,上調IFN表達, 促進抗原遞呈細胞(APCs)活化和抗原呈遞, 活化細胞毒性T淋巴細胞(CTLs),增加腫瘤微環境內T細胞浸潤,同時阻斷原有以及IFN上調的多種免疫檢查點配體介導的免疫逃逸(圖1B)。
研究數據顯示,OPEN能特異性靶向腫瘤,高效誘導瘤內IFN分泌,上調腫瘤細胞PDL1和主要組織相容性復合體-I(MHC-I)等的表達,并進一步促進OPEN攝取,產生自增強效應,將瘤中CTLs浸潤增加了29倍,顯著降低ORY-1001的免疫副作用(圖1C),在動物模型上有效抑制三陰性乳腺癌、黑色素瘤或結腸癌的生長(圖1D)。該研究開拓了精準遞送+智能釋藥一體化技術調控表觀遺傳、克服免疫耐受、改善腫瘤免疫治療的新方向,為提高包括IFN在內的兼具抗癌活性和促進免疫逃逸的活性分子療效以及降低其免疫副作用提供了新思路。
上海藥物所博士研究生翟藝慧和上海交通大學仁濟醫院博士研究生王金名為該論文第一作者,上海藥物所李亞平研究員和張鵬程研究員為論文共同通訊作者。上海交通大學朱鶴研究員,國家蛋白質科學中心(上海)于洋研究員和王研科工程師,中科環渤海(煙臺)藥物高等研究院和煙臺藥物所榮榮博士、孔穎工程師,上海藥物所博士后郎天群及研究生蔡穎、冉偉、熊鳳琴和鄭超等參與相關研究工作,該工作還得到了上海交通大學鄧劉福研究員和上海藥物所王江研究員的幫助。研究工作同時得到了國家自然科學基金、中國科學院青年創新促進會和山東省自然科學基金的支持。
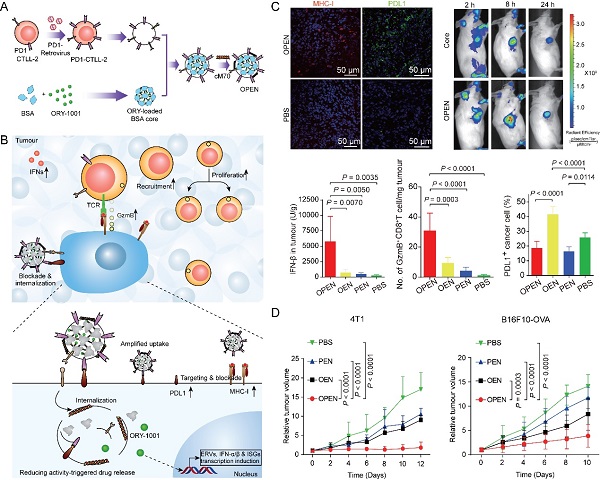
圖1:(A). PD1過表達CTLL-2細胞的構建和負載ORY-1001納米囊泡(OPEN)的制備。(B). OPEN被腫瘤細胞PDL1識別并入胞,上調IFN表達,增加腫瘤微環境內T細胞浸潤并促進CTL活化,同時阻斷PDL1介導的免疫逃逸。(C). OPEN特異性靶向腫瘤,顯著上調瘤內IFN表達,促進抗原遞呈,提高腫瘤中細胞毒性T細胞浸潤并有效解除ORY-1001造成的免疫抑制。(D). OPEN顯著抑制乳腺癌和黑色素瘤的生長。
原文鏈接:https://doi.org/10.1038/s41565-021-00972-7
專家點評1: 郝希山
中國工程院院士 腫瘤治療學專家

表觀遺傳失調是誘發腫瘤發生發展的關鍵因素之一,但其作用機制仍不十分清楚。最近有研究表明,基因組內反轉錄因子的激活是表觀遺傳調節劑發揮抗腫瘤活性的一個重要機制,反轉錄因子的轉錄將導致dsRNA的胞內累積,進而結合并刺激模式識別受體,觸發I型IFN的產生。腫瘤微環境(TME)中的IFN自分泌和旁分泌信號可進一步促進其他多種促炎因子和趨化因子的分泌,增加抗原呈遞和免疫細胞浸潤,提高免疫療法抗腫瘤的效果。然而,促炎因子可同時誘導多重免疫檢查點上調,造成腫瘤細胞免疫逃逸,進而限制表觀遺傳調節劑的抗腫瘤活性。表觀遺傳療法存在的另一個大問題是藥物對腫瘤的選擇性差,表觀遺傳藥物作用靶點廣泛,脫靶效應易產生副作用,如骨髓抑制、中樞神經毒性等,即使與化療、放療、分子靶向治療和免疫治療結合,仍難以避免兩種游離藥物聯合使用引起的副作用,所以亟需開發更合理的用法及靶向策略。
最近,中科院上海藥物研究所李亞平團隊報道了一種表觀遺傳與免疫療法結合新策略:他們構建了一種基因工程化T淋巴細胞膜包載的仿生表觀遺傳調控納米粒,顯著提高了表觀遺傳藥物的特異性。他們將LSD1的抑制劑(ORY-1001)包載到過表達PD1的T淋巴細胞膜囊泡中獲得一種仿生納米載藥系統(OPEN),OPEN能特異性識別腫瘤細胞表面的PDL1,實現ORY-1001的靶向遞送,促進單甲基化和二甲基化H3K4的累積。釋放的ORY-1001上調IFN和下游干擾素刺激基因的表達(如MHC-I和PDL1)。MHC-I的上調可增加抗原遞呈,促進T淋巴細胞對腫瘤細胞的識別,而上調的PDL1則被OPEN結合并中和。與游離的ORY-1001相比,OPEN可顯著增加瘤內藥物聚集,減少靜脈注射后藥物在肝臟的暴露,顯著降低ORY-1001的副作用。腫瘤內的ORY-1001通過促進DC細胞熟化、細胞毒T淋巴細胞的增殖和腫瘤細胞抗原展示,重塑腫瘤免疫微環境(由“冷”到“熱”)。在多種腫瘤動物模型中,OPEN也均顯著抑制腫瘤的生長,延長小鼠的生存期。
該工作首次將表觀遺傳藥物仿生納米化并與免疫療法相結合,實現了表觀遺傳藥物的腫瘤靶向遞送和免疫檢查點阻斷效應,成功解決了表觀遺傳療法的特異性差和效果具有兩面性二大關鍵難題,是表觀遺傳療法與免疫療法有效結合治療腫瘤的一個重大進展。
點評原文鏈接:http://www.cancerbiomed.org/index.php/cocr/article/view/1921
專家點評2: 趙宇亮

中國科學院院士 國家納米科學中心主任 Nano Today主編
免疫檢查點阻斷(ICB)和過繼細胞免疫療法是癌癥治療領域的革命性進展,在抑制腫瘤生長和預防復發方面具有極大臨床價值,但目前癌癥免疫治療仍面臨幾個重大挑戰,如響應率低,腫瘤T淋巴細胞浸潤少易導致嚴重免疫相關不良反應等。納米遞藥系統由于具有靶向遞送、共遞送和藥物釋放時空可控等特性,已引起生物醫學領域的廣泛關注。
中科院上海藥物所李亞平團隊長期致力于納米遞藥系統(NDDS)在癌癥免疫治療領域的研究,他們提出了精準遞送+智能釋藥一體化的載體設計新理念,取得了諸多開創性成果,如將納米化抗體和光療結合提高了ICB療法的效果和安全性;構建共載BRD4抑制劑和光敏劑的水凝膠疫苗,有效抑制癌癥的復發和轉移等。
最近,他們構建了一種新的表觀遺傳納米誘導劑,在癌癥免疫治療方面取得了重大突破。LSD1的缺失將導致I型IFN和干擾素刺激基因(ISG)的上調,進而激活先天性和獲得性免疫。然而,IFN通路激活導致多種免疫檢查點上調而產生的腫瘤免疫耐受仍是目前癌癥免疫治療面臨的一個主要問題。李亞平和合作者將LSD1抑制劑(ORY-1001)包載到PD1過表達的工程化T淋巴細胞膜囊中,構建了一種新型表觀遺傳免疫納米調節劑OPEN。OPEN經靜脈注射后可被PDL1過表達的腫瘤細胞主動識別并內吞,在胞內GSH作用下,ORY-1001快速釋放后激活IFN信號通路,上調MHC-I和PDL1,促進腫瘤細胞抗原展示和DC抗原提呈,增加細胞毒T淋巴細胞的瘤內浸潤,上調的PDL1可增強OPEN的識別和內吞,進一步促進IFN分泌的同時阻斷多重免疫檢查點的抑制作用。實驗結果顯示:OPEN可使腫瘤浸潤細胞毒T淋巴細胞增加29倍,并在動物模型上對三陰性乳腺癌、黑色素瘤、結腸癌等多種腫瘤的生長具有很好的抑制作用。
該研究工作首次報道NDDS運載表觀遺傳藥物并與免疫療法相結合,克服免疫耐受,提高了表觀遺傳調控的特異性和免疫療法的效果,具有顯著的原創性和獨特性:首先,由于表觀遺傳調節劑的靶點在體內普遍存在,游離形式的表觀遺傳調控藥物往往具有系統性副作用(如骨髓抑制、中樞神經毒性等),OPEN顯著提高了表觀遺傳治療的特異性,增加了瘤內藥物的富集,降低了藥物副作用;其次,通過基因工程方法構建的T淋巴細胞膜過表達多種免疫檢查點受體,在提高OPEN靶向性時,還降低IFN信號通路激活帶來的免疫檢查點上調產生的副作用;另外,OPEN可自動補充腫瘤細胞上PDL1等多種免疫檢查點配體,避免其消耗引起的脫敏,使OPEN實現可持續特異性累積。該研究將表觀遺傳藥物促進多種免疫檢查點表達的副作用巧妙地轉化為腫瘤特異性靶點,成功解決了表觀遺傳藥物具有的兩面性難題,是采用NDDS提高癌癥免疫療法效果和安全性的一個里程碑式新進展。
點評原文鏈接:https://doi.org/10.1007/s11426-021-1108-0
、
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn