(圖片來源:Angew. Chem. Int. Ed.)
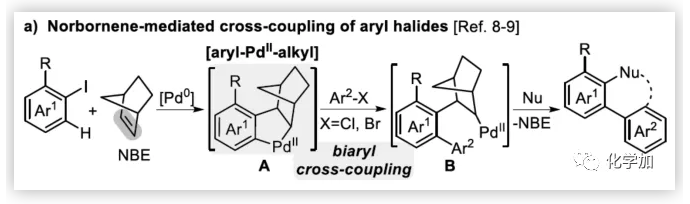
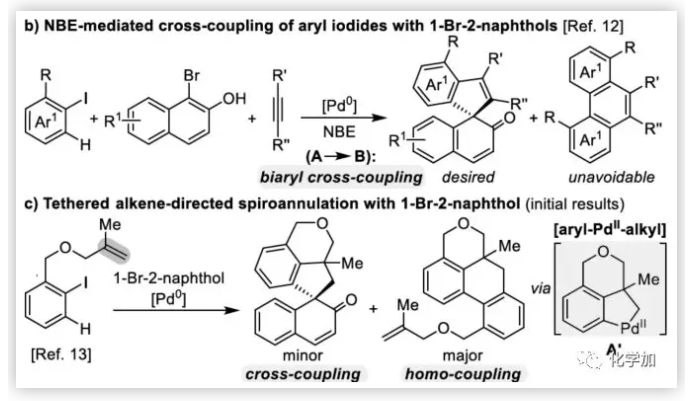
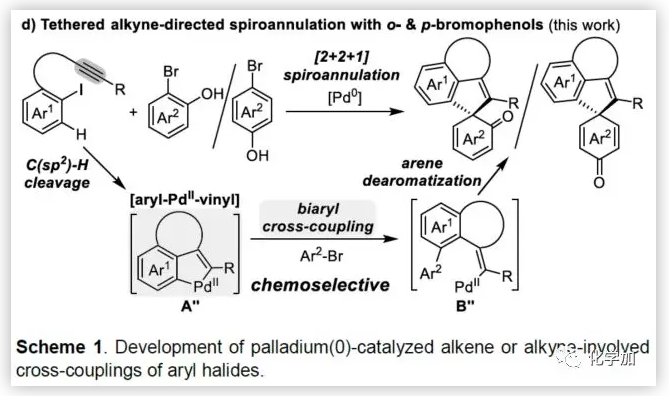
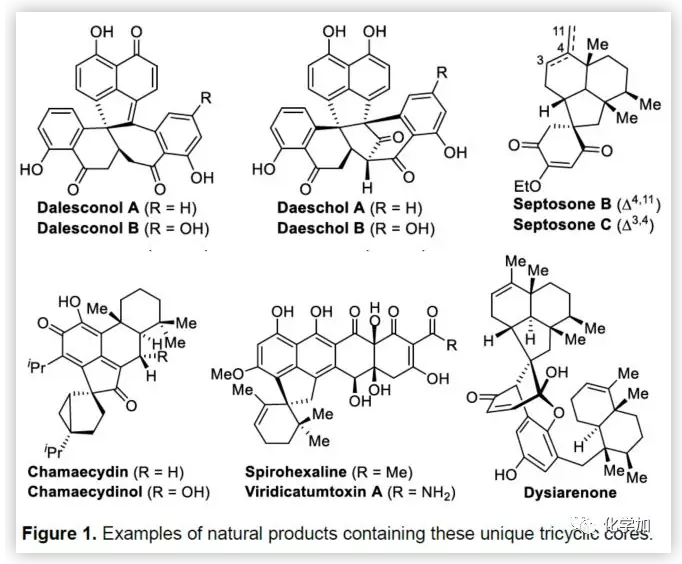
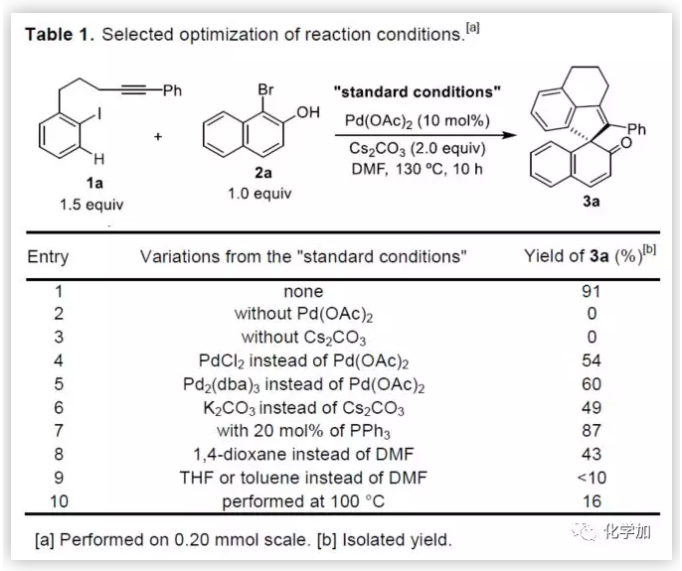
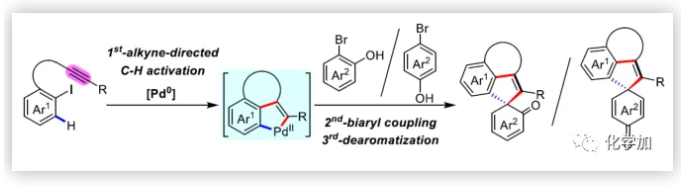
聯芳基骨架廣泛存在于生物活性的天然產物、藥物、手性配體和功能材料中。雙分子芳基鹵化物偶聯是合成聯芳基化合物最有效和通用的方法。自1901年Ullmann和Bielecki發現芳基鹵化合物還原二聚的方法以來,現已成為制備對稱聯芳基的有效途徑之一。在過去的幾十年中,C-H官能團化的發展極大地革新了由兩個芳基鹵化物生成聯芳基的策略,同時建立了逆合成分析的新范例。而Catellani反應(降冰片烯與Pd共同催化)作為典型的代表,已成為直接構建無數非對稱聯芳基非常有效的方法。為了制備多種非對稱的聯芳基多環骨架,需要對兩個底物進行修飾,方法為鄰位帶有給電子基的芳基碘化物和帶有吸電子的芳基鹵化物(Cl或Br)進行反應(Scheme a)。 (圖片來源:Angew. Chem. Int. Ed.)基于作者對金屬催化去芳化反應的長期研究,以及前期在Angew(2017, 56, 2767)發表的一篇論文(主要介紹鈀和NBE共催化下實現1-溴-2-萘酚、芳基碘化物和炔烴[2+2+1]螺增環反應,而此反應的主要障礙是芳基碘化物的自身偶聯)的基礎上(Scheme b),作者提出了一種含烯烴的芳基碘化物與1-溴-2-萘酚經中間體A'實現螺增環反應(Scheme c)。與前期工作相比,螺環化反應從分子間變為分子內反應,從而避免自偶聯的產生。但經過長期的嘗試,作者發現,由于含烯烴的芳基碘化物也存在自身偶聯問題,導致該反應很難順利進行。 (圖片來源:Angew. Chem. Int. Ed.)基于失敗的經驗,作者提出另一種設想,選擇含炔烴的芳基碘化物與鄰溴酚進行反應,通過芳基/乙烯基環鈀中間體A''的參與抑制芳基碘化物二聚化(A、A'比A''更富電子),實現炔烴選擇性的交叉偶聯。在這里,作者成功開發了Pd(0)催化炔烴定向[2+2+1]螺增環反應,涉及C-H活化、聯芳基形成和芳烴去芳化等(Scheme 1d)。(圖片來源:Angew. Chem. Int. Ed.)此外,該類化合物被視為生物活性分子的核心骨架,如Dalesconols, Daeschols, Septosones等 (Figure 1)。因此,合成該骨架結構具有重要的意義。 (圖片來源:Angew. Chem. Int. Ed.)作者,首先以1a和2a作為模型底物進行了條件篩選(Table 1)。令作者驚訝的是,這些底物在非常簡單的條件下(entry 1)經化學選擇性[2+2+1]螺環化反應,獲得五環產物3a(收率91%)。為了闡明每種反應物的作用,作者繼續進行了一些對照實驗。催化量的鈀和化學計量的堿在炔烴定向C-H活化和芳烴去芳化的多米諾過程中起著關鍵作用(entries 2-3)。其它的鈀源(PdCl2和Pd2(dba)3)堿(K2CO3)也適用,但導致3a收率降低(entries 4-6),而膦配體的參與并沒有影響反應結果(entrie 7)。此外,溶劑和溫度也都對反應至關重要(entries 8-10)。與之前通過Pd(0)/NBE協同催化進行的反應相比,該反應具有反應簡單(無需NBE和配體參與)、高合成效率(收率高達91%)以及避免了芳基碘化物二聚等優點。 (圖片來源:Angew. Chem. Int. Ed.)
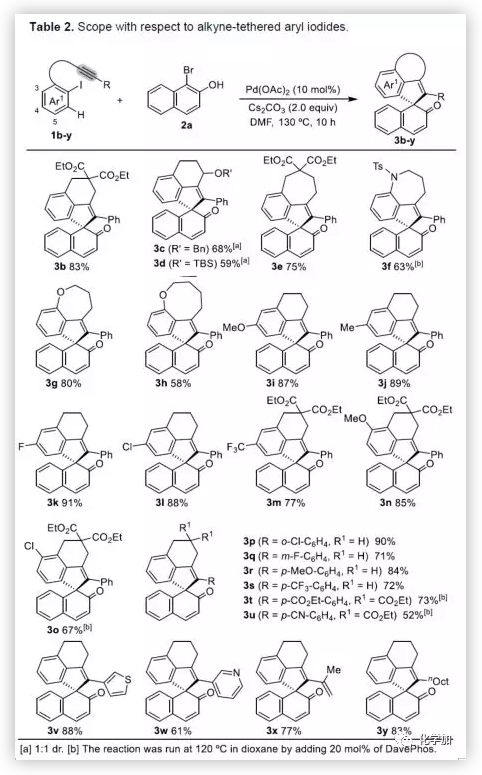
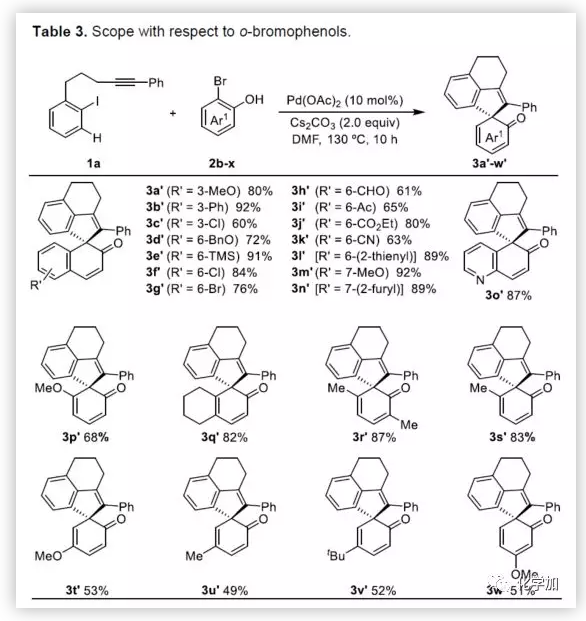
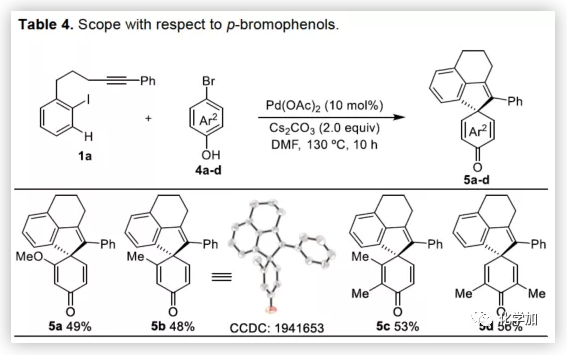
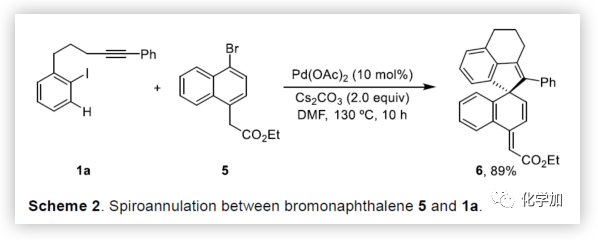
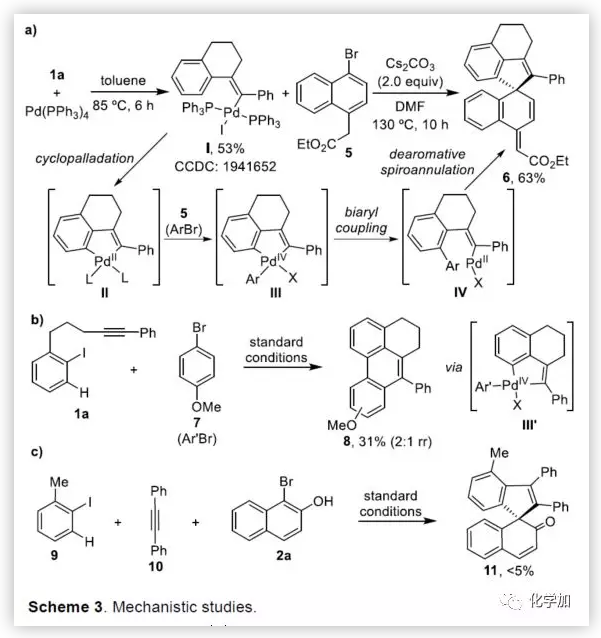
在獲得上述最佳反應條件后,作者開始對底物進行了擴展(Table 2)。首先,以溴代萘酚2a與含炔烴的芳基碘化物進行底物擴展,獲得產物3b-y,均取得良好的收率(52-91%)。此外,通過炔烴鏈的增長,該方法可以合成含雜原子(O、N)的七、八環螺環化物(3e-3h),同時電子效應和定位效應(芳基3,4-位)對反應影響不大(3i-3o),但是芳基5-位取代由于存在空間位阻的原因導致不能形成環鈀中間體,以致不能實現C-H活化。而炔基取代的部分,同樣不受電子效應的影響(3m-3u),雜環化合物(3v-3w)、烯烴(3x)和脂肪烴(3y),均能夠保持相同的活性和選擇性。(圖片來源:Angew. Chem. Int. Ed.)隨后,作者對底物溴代萘酚2a進行了擴展。首先,作者將1-溴-2-萘酚的3,6,7-位不同取代的化合物分別與1a進行反應,反應結果令人滿意(收率60-92%),更為重要的是,一些敏感性基團能夠在反應中不受影響,如三甲硅烷基、鹵原子、甲(乙)酰基、酯、氰基等(3c'-3k')。此外,雜環底物也能順利反應,以87%的收率得到3o'。一些簡單的溴酚同樣可以合成螺環產物(3r'-3w')。 (圖片來源:Angew. Chem. Int. Ed.)為了驗證鄰溴酚的羥基是否在形成環鈀中間體進行聯芳基偶聯中起關鍵作用,作者將對溴苯酚引入反應體系。令人滿意的是,底物4a-d與1a均很好地參與了[2+2+1]螺環合成,獲得產物5a-d(收率48-56%),化合物5b的結構得到單晶確證。這些結果表明,鄰位螯合基團(通常在環鈀中間體的促進下,實現聯芳基交叉偶聯)對于該反應并不是關鍵因素。 (圖片來源:Angew. Chem. Int. Ed.)受上述結果的鼓勵,作者進一步嘗試使用溴萘5來進一步擴大底物的范圍,反應結果顯示,以89%的收率得到去芳化產物6(Scheme 2)。 (圖片來源:Angew. Chem. Int. Ed.)為了進一步了解反應機理,作者進行了一些對照實驗(Scheme 3)。首先,1a通過分子內碳鈀化反應,形成配合物I,再與當量的芳基溴化物5反應獲得螺環產物6,產率為63%(Scheme 3a)。同時根據文獻的總結,通過環鈀化反應形成關鍵中間體II,隨后與溴代芳基物進行配位,形成四價Pd配合物III,進而進行分子間聯芳基偶聯,去芳化螺環化反應,形成產物6(Scheme 3a)。為了進一步驗證反應機理的正確性,作者以1a與7進行反應(Scheme 3b),結果表明:(1)四價鈀III'和III作為該類反應的中間體;(2)III'的還原消除和C-H芳基化分兩步實現。此外,三組分反應表明(Scheme 3c),含烷基醚的碘代芳基對于這兩種不同的芳基鹵化物的分子間交叉偶聯至關重要。 (圖片來源:Angew. Chem. Int. Ed.)總結:西北大學欒新軍教授課題組開發了一種Pd(0)催化下實現含炔烴的芳基鹵化物與溴代酚[2+2+1]的螺環化反應,以優秀的化學選擇性和產率形成了新穎的螺環骨架化合物。通過關鍵中間體芳基/乙烯基鈀環的引入,避免了各類自偶聯的產生,同時不受文獻中鄰位螯合基團的影響,具有底物簡單易得、底物范圍廣泛等優點。
撰稿人:彬彬