



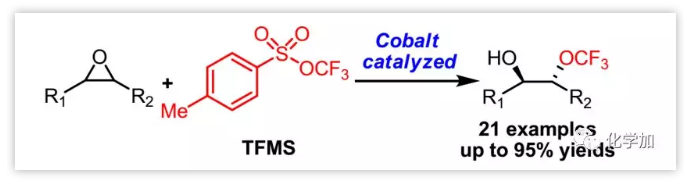
環(huán)氧化物的親核開環(huán)是通過單步反應獲得有機分子雙官能團的重要方法,主要親核試劑包括胺、硫醇、羥基、苯酚、羧酸、疊氮化物、氰化物、鹵素等;相比之下,由于三氟甲氧基(OCF3)陰離子的弱親核性和不穩(wěn)定性,限制了其用作環(huán)氧化物開環(huán)反應中的親核試劑。此外,使用高壓(4 MP)的有毒氟光氣作為三氟甲氧基陰離子(-OCF3)的來源增加了操作的風險和難度。因此,三氟甲氧基陰離子對環(huán)氧化物的親核開環(huán)極具挑戰(zhàn)性。
最近,湯平平課題組報道了TFMS作為三氟甲氧基化試劑的一系列應用,其三氟甲氧基陰離子-OCF3可由AgF、CsF原位生成(Figure 1a)。作者猜測是否有可能通過TFMS的三氟甲氧基陰離子實現(xiàn)環(huán)氧化物的親核開環(huán)。其面臨主要問題包括:a)由于氟化物陰離子可能發(fā)生環(huán)氧化物的親核開環(huán),所以氟化物鹽不適合激活TFMS以產(chǎn)生-OCF3;b)如何穩(wěn)定三氟甲氧基陰離子。對于以上問題,作者假設催化劑SalenCoX(Figure 1c)的軸向陰離子X可與TFMS反應產(chǎn)生-OCF3,并對環(huán)氧化物(1)開環(huán)得到中間體A,其與從-OCF3原位產(chǎn)生的氟光氣反應形成中間體B,然后經(jīng)后處理得到所需的鄰位三氟甲氧基氫化物(3);從-OCF3分解的氟化物進一步用于在反應過程中用TFMS產(chǎn)生-OCF3(Figure 1b)。
(圖片來源:J. Am. Chem. Soc.)
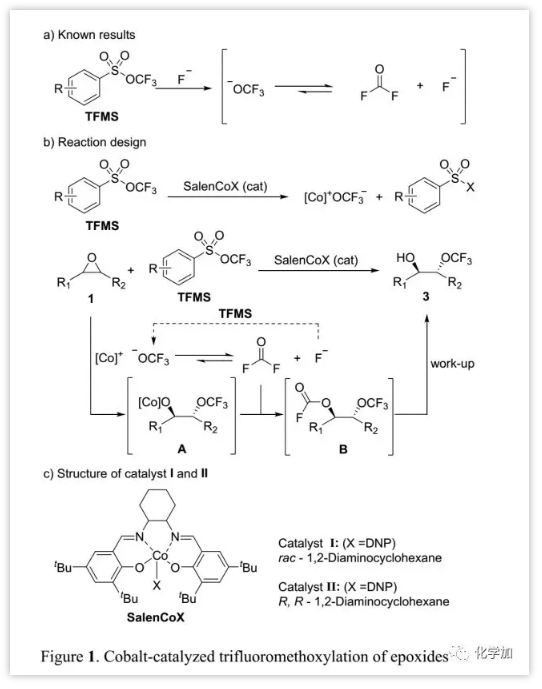
作者以2,3-環(huán)氧-1,2,3,4-四氫化萘(1a)作為模型底物對反應條件進行了優(yōu)化(Table 1)。首先,篩選了SalenCoX的不同軸向陰離子X。與其它Lewis酸相比,當使用10% mol SalenCoOTs作為催化劑時,以17%產(chǎn)率得到產(chǎn)物3a;吸電子軸向陰離子X如PhCO2-, CF3CO2-和DNP催化活性最佳,而DNP的催化產(chǎn)率最高(73%)。相反,親核性差的陰離子如BF4-和SbF6-抑制了產(chǎn)物的形成。軸向陰離子DNP的作用不僅易于與金屬中心解離以活化環(huán)氧化物,而且還可以與TFMS反應生成-OCF3。Langlois及其同事報道n-Bu4N+可穩(wěn)定-OCF3,因此當使用10% mol n-Bu4N+DNP-得到最高產(chǎn)率(88%),而進一步增加銨鹽的量對反應則具有負面影響。當使用3.0 eq.的TFMS時,產(chǎn)率進一步提高至97%。通過對照反應發(fā)現(xiàn),無鈷催化劑時沒有產(chǎn)生三氟甲氧基化產(chǎn)物。在對反應條件進行廣泛優(yōu)化后,最終發(fā)現(xiàn)1a于室溫氮氣保護情況下,在乙腈中使用10% mol催化劑I,10% mol n-Bu4N+DNP-, 3 eq TFMS (2)進行反應時,可以97%產(chǎn)率得到3a。
(圖片來源:J. Am. Chem. Soc.)
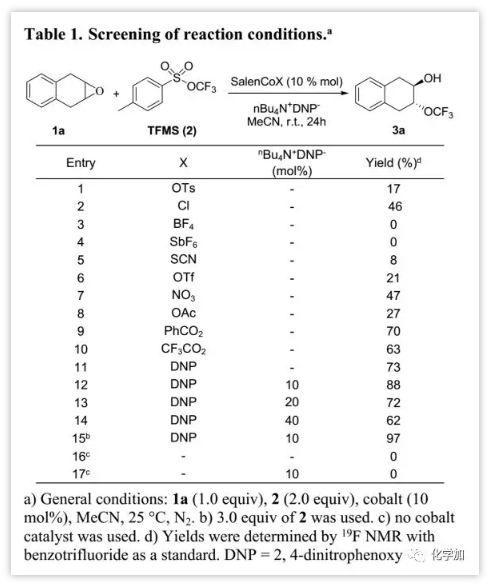
在優(yōu)化的條件下,作者研究了內(nèi)消旋-環(huán)氧化物與TFMS開環(huán)反應的適用范圍(Table 2)。研究發(fā)現(xiàn),五元、六元、七元環(huán)底物可以45%~95%的產(chǎn)率轉化為預期的鄰位三氟甲氧基氫化物,產(chǎn)率范圍為;非環(huán)狀底物1e和1f也可以高產(chǎn)率轉化為所需產(chǎn)物(3e,3f)。此外,該轉化反應可以耐受底物中一些官能團(如酯,醚和酰胺等)。另外,通過氟化物進行環(huán)氧化物開環(huán),可以得到少于5%的氟化副產(chǎn)物。
(圖片來源:J. Am. Chem. Soc.)
除了內(nèi)消旋-環(huán)氧化物外,作者還研究了外消旋環(huán)氧化物(Table 3)。研究發(fā)現(xiàn),末端環(huán)氧化物更容易轉化為鄰位三氟甲氧基氫化物(3m-3r);并且醚、腈和鹵素等基團均耐受。此外,作者發(fā)現(xiàn)催化體系在底物1m-1p的開環(huán)中具有優(yōu)異的區(qū)域選擇性,僅生成仲醇3m至3p;底物1q和1r反應中具有高區(qū)域選擇性,并且發(fā)現(xiàn)少于2%的伯醇副產(chǎn)物。受此啟發(fā),作者認為該催化體系可以在開環(huán)過程中保留次甲基碳的立體化學。因此,作者利用手性純底物(S)-1m以88%的產(chǎn)率得到產(chǎn)物3m(ee>99%),表明催化劑I主要在(S)-1m的亞甲基碳上誘導開環(huán),并保持次甲基碳的立體化學。然而,當用苯乙烯環(huán)氧化物1s作底物時,由于空間和電性因素與親核進攻沖突,產(chǎn)生較低的區(qū)域選擇性。不對稱內(nèi)式環(huán)氧-烷烴1t的轉化表明空間因素對開環(huán)位置具有很大影響,-OCF3更有利于進攻環(huán)氧中位阻較小的碳得到產(chǎn)物3t作為主要產(chǎn)物。除區(qū)域選擇性外,催化劑I在具有兩個不同環(huán)氧基的底物1u開環(huán)中也顯示出了優(yōu)異的化學選擇性,并且由于左環(huán)氧基具有空間位阻,開環(huán)僅發(fā)生在末端環(huán)氧基處。
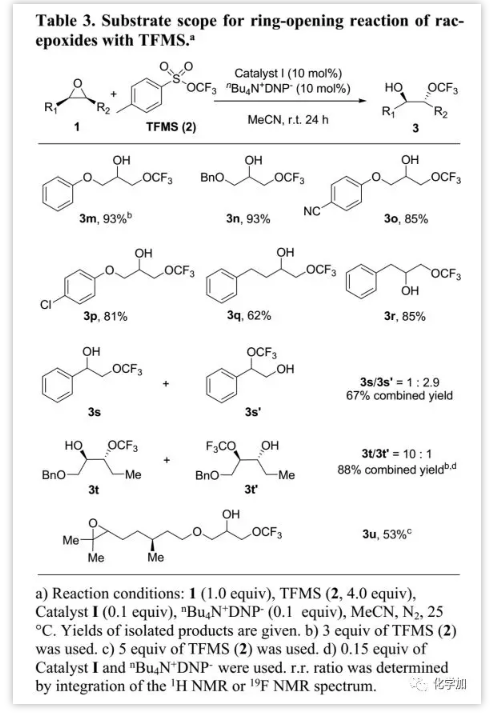
(圖片來源:J. Am. Chem. Soc.)
最后,作者還研究了通過三氟甲氧基化陰離子對環(huán)氧化物的不對稱開環(huán)。起初,用手性純催化劑II進行內(nèi)消旋-環(huán)氧化物(1a)的去對稱化,僅以95%收率和6%的ee值得到產(chǎn)物3a,并且外消旋-環(huán)氧化物(1m)的動力學拆分產(chǎn)物3m產(chǎn)率為80%,ee值為13%。為解釋此現(xiàn)象,作者進行了初步研究以了解其反應機制。Jacobsen報道金屬salen復合物不僅作為Lewis酸活化環(huán)氧化物,還通過雙金屬配合作為親核試劑,這是實現(xiàn)環(huán)氧化物高對映選擇性開環(huán)的關鍵點。因此,作者通過19F NMR監(jiān)測在乙腈中催化劑II和TFMS的混合物以表明SalenCoOCF3的存在(約-18.8 ppm,Figure 2)。此外,關于催化劑II的動力學研究揭示了速率常數(shù)(k)與[催化劑II]之間的線性相關性,反映了對催化劑的二級依賴性;通過利用Burés開發(fā)的可變時間歸一化分析圖形方法分析數(shù)據(jù)也得出了相同的結論。這些觀察結果提供的確鑿證據(jù),表明在環(huán)氧化物與TFMS的開環(huán)反應中存在雙金屬配合。Jacobsen進一步提出了兩種限制幾何形狀的對映體確定過渡狀態(tài):“頭對頭”和“頭對尾”。其中,只有“頭對尾”的幾何形狀才能誘導環(huán)氧化物的不對稱開環(huán),這可以通過二聚體salen-鉻絡合物(類似于Figure 3中的催化劑III)證實,其可以通過分子內(nèi)雙金屬途徑模擬“頭到尾”的幾何形狀。然而,當用手性催化劑III進行1a與TFMS開環(huán)時,除產(chǎn)生三氟甲氧基化產(chǎn)物3a(47%,19F NMR產(chǎn)率)外,還存在氟化產(chǎn)物3aa(40%,19F NMR產(chǎn)率);這表明氟化產(chǎn)物3aa是通過分子內(nèi)雙金屬途徑(“頭對尾”)產(chǎn)生的,而三氟甲氧基化產(chǎn)物3a不是。因此,催化劑II的一個鈷中心很難誘導-OCF3通過“頭到尾”幾何形狀接近由另一個鈷中心活化的環(huán)氧化物。阻礙屏障可能是由CF3和活化的環(huán)氧化物或salen配體之間的空間排斥引起的,并且這也可以解釋為何催化劑II在TFMS進行環(huán)氧化物開環(huán)中立體控制性喪失。
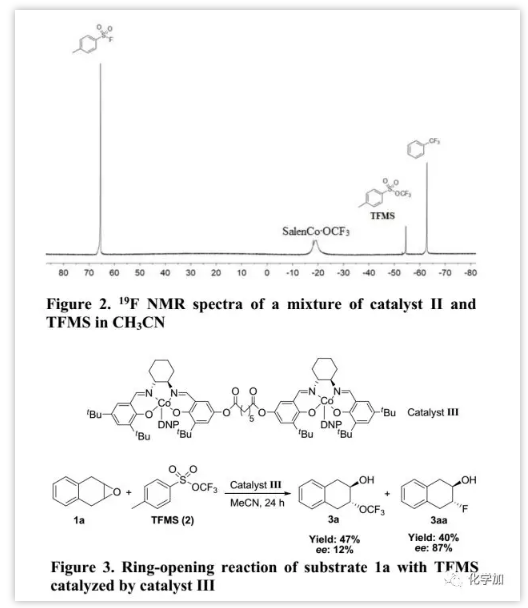
(圖片來源:J. Am. Chem. Soc.)
小結:南開大學湯平平課題組開發(fā)了一種鈷催化的通過三氟甲基芳基磺酸鹽(TFMS)對環(huán)氧化物進行親核開環(huán)產(chǎn)生三氟甲氧基化產(chǎn)物的反應。該反應可以在溫和條件下直接構建多種鄰位三氟甲氧基羥基化合物,并且具有廣泛的官能團耐受性,另外,該方法還可以將末端環(huán)氧化物轉化為具有良好化學和區(qū)域選擇性的目標產(chǎn)物,在含三氟甲氧基的活性化合物合成中具有重要應用價值。
撰稿人 | 爽爽的朝陽
聲明:化學加刊發(fā)或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網(wǎng)聯(lián)系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn