

金屬硫簇合物作為無機化合物中一個普遍存在的類別,表現出有意思的結構和電子特征。蛋白質包裹型簇合物具有一個獨特的功能,比如說,固氮酶中鐵鉬輔因子(如圖1所示)介導下,可以將N2轉化成NH3。另外,鐵鉬輔因子可以從蛋白質中被提取出來至有機溶劑中,且依然保持住其間的金屬-硫簇核心。盡管提取出的鐵鉬輔因子可以在還原性試劑和質子存在下,催化還原非原生性的C1原料,如CO和CO2,形成CH4或短碳鏈的碳氫化合物。然而N2卻不能被提取出的鐵鉬輔因子或類似合成物催化還原。而這一點進一步表明了蛋白質包裹型鐵鉬輔因子與存在于溶液中分立的金屬硫簇合物在催化還原N2活性的差異性。雖然已有文獻報道,如一些水相懸浮或乳化的鐵-硫或鐵-鉬-硫化合物可以將N2催化還原成NH3,以及一些硫醇負載的鐵化合物可以活化N2,然而在分子水平上設計金屬硫簇合物用于N2的催化還原依然存在挑戰性。盡管立方體型簇合物,Cp*3Ir3S4Ru(tmeda)(N2)(tmeda?=?四甲基乙二胺),是目前僅有一例經結構明確的N2結合在金屬上的金屬硫簇合物,然而該結構中釕結合的N2發生進一步轉化的行為卻沒有實現。
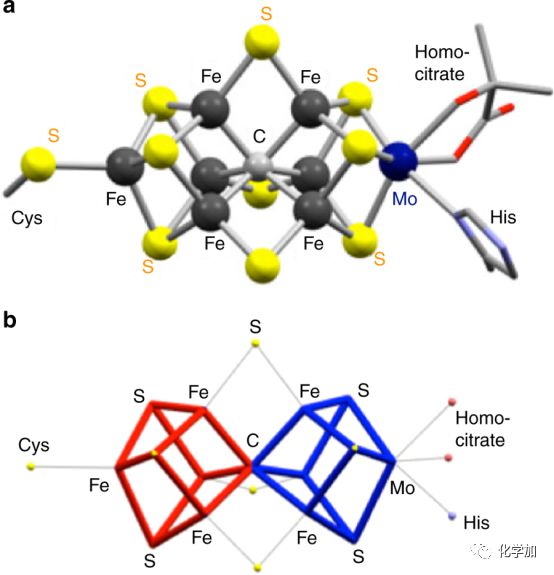
圖1. 固氮酶中鐵鉬輔因子的結構示意圖:a)靜態結構圖;b)鐵鉬輔因子的無機結構部分的線框示意圖。
作者們通過細致研究鐵鉬輔因子的結構,發現該結構可以看作是兩個立方體的融合形式(如圖1所示),進而推斷立方體構型的成鍵形式在活化N2方面具有優勢。同時兼顧發展基于合成的金屬硫簇合物進行N2活化的策略,他們就此構建了一個新型的以三核鉬-硫簇,Cp*3Mo3(μ-S)3(μ3-S)(1)(如圖2所示),為基元的立方體結構單元,其中鉬-硫簇合物的配位方式為三個雙橋硫原子連接一個鉬原子。再結合鈦配合物用于N2活化的最新報道,他們設計出含鉬-鈦-硫的[Mo3S4Ti]簇合物(2)(如圖2所示)。該[Mo3S4Ti]簇合物在N2存在下被還原,產生可以活化N2的鈦基反應位點,進而將N2轉化成NH3和N2H4。詳細的合成、表征及轉化過程,將在下面細致分析。
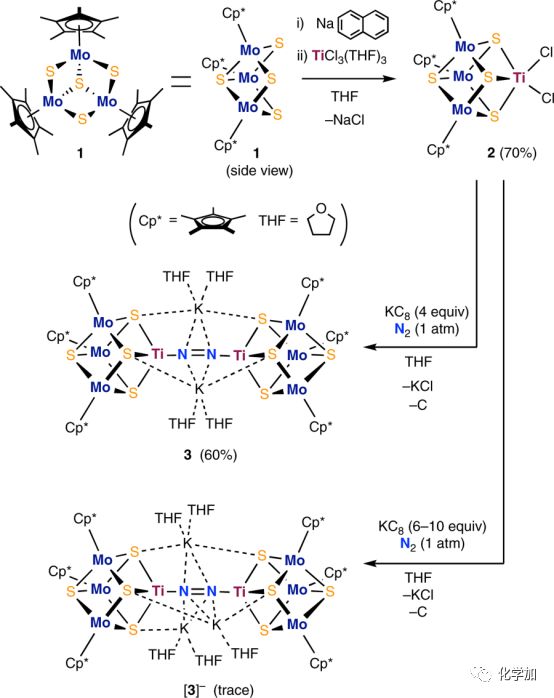
圖2. 三核鉬-硫簇Cp*3Mo3(μ-S)3(μ3-S)(1)、[Mo3S4Ti]簇合物(2)及結合N2的鉬-鈦-硫簇合物(3)的相關反應路線圖及化學結構式圖
立方體[Mo3S4Ti]簇合物2和結合N2的簇合物3的合成與表征。
①史萊克反應條件下,三核鉬-硫簇1在含鈉和萘的四氫呋喃溶液中原位生成[1]-,其再與TiCl3(THF)3反應可以得到立方體[Mo3S4Ti]簇合物2(反應路線如圖2所示)。
②晶體結構顯示[Mo3S4Ti]簇合物2中,鈦原子呈現近四方錐配位模式,S3硫原子則處于四方錐的頂點(如圖3顯示的S3原子)。其中Ti-S3的鍵長都短于Ti-S1和Ti-S2的鍵長;Ti–Cl鍵長則跟常見的Ti(III)–(Cl)3配合物中的Ti-Cl鍵長接近。
③使用特制的H型玻璃反應器(如圖4所示),在氮氣氛圍下,在石墨鉀(KC8,potassium graphite)的四氫呋喃溶液中,[Mo3S4Ti]簇合物2與N2發生配位并還原,進而形成結合N2的簇合物3,[K(THF)2]2[Cp*3Mo3S4Ti]2(μ-N2)(化學結構式如圖2所示,晶體結構如圖5所示)。
④需要指出的是,采用第③條的反應條件,在H2或Ar氛圍下,形成的產物還沒有被鑒定出。
⑤3的晶體結構顯示(如圖5所示),N2以近直線橋聯排列方式與兩個立方體[Mo3S4Ti]單元中的鈦原子配位,形成Ti–N=N–Ti單元。對比已有文獻報道的含Ti–N=N–Ti的配合物,3中的N=N鍵長(1.294(7) ?)是最長的,這一點表明3中的N2具有高的還原活性。同時,3中的N–N鍵長比H3CN=NCH3(1.25 ?)的N=N雙鍵長,而比H2N–NH2(1.46 ?)的N–N單鍵短,這一點表明3中的N=N鍵的活性介于這兩個鍵之間。
⑥共振拉曼光譜顯示3中的νNN振動頻率(1240 cm?1)落在H3CN=NCH3的νNN振動頻率(1575 cm?1)和H2N–NH2的νNN振動頻率(1111 cm?1)之間,進一步表明3中的N=N鍵的活性介于這兩個鍵之間。
⑦值得注意的是,Cp*–Mo和Mo–S鍵具有強穩定性,一方面可以避免立方體[Mo3S4Ti]單元因聚集或碎片化而分解,另一方面在活化N2過程中,由于三個鉬原子依舊保持完整性,而促使立方體[Mo3S4Ti]單元中Ti原子成為反應位點。
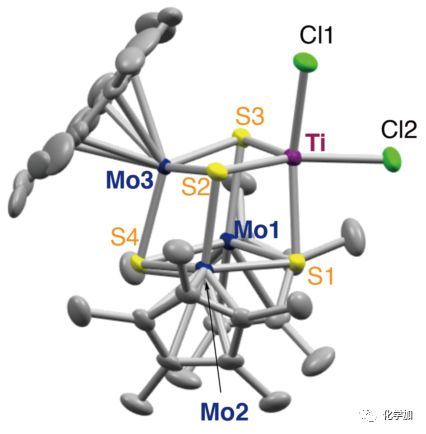
圖3. [Mo3S4Ti]簇合物2的晶體結構圖。
圖4. 文中用于合成簇合物3的特制的H型玻璃反應器。
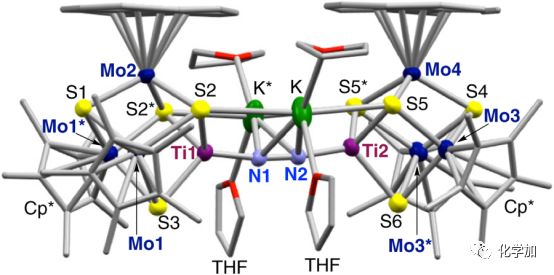
圖5. 簇合物3,[K(THF)2]2[Cp*3Mo3S4Ti]2(μ-N2),的晶體結構圖。
簇合物3中的N2片段轉化成NH3和N2H4。
①往3中加入H2O或HCl時,樣品的顏色從棕色變成綠色,同時有NH3、N2H4和[1]+生成。文中,作者們采用靛酚和偶氮染料的滴定法,對生成的NH3和N2H4進行定量分析。關于產物中出現N2H4,作者們認為是由于3中的N=N鍵表現出部分的N=N雙鍵和部分的N–N單鍵的特性。關于產物中出現[1]+,作者們推斷3中加入過量的質子酸,隨著N2片段被還原,鈦原子則從立方體[Mo3S4Ti]單元中解離出來而恢復成[1]+的結構。
②如表1中條目1和4所示,在沒有外加還原劑條件下,3與過量的H2O或HCl反應,僅產生少量或適量的NH3和N2H4。
③如表1中條目2和5所示,在加入6當量還原劑石墨鉀后,3與過量的H2O或HCl反應,產生NH3的量都有提高,而產生N2H4的量則基本持平。
④對比表1中條目1與4及條目2與條目5,不管是否有還原劑石墨鉀的參與,3與過量的H2O產生N2H4的量均是3倍于3與過量的HCl產生N2H4的量。關于這一點,作者們認為這種質子調控的反應活性,需要對比其共軛堿(OH–或Cl–)對金屬的親和性,而正因為3中的鈦原子和鉀原子具有高親氧性,所以促使H2O與鈦原子和鉀原子的配位,進而導致鄰近的Ti–N=N–Ti單元被更高效地質子化。
⑤再次對比表1中條目2與條目5,即使加入稍微過量(6當量)的石墨鉀,3中的N2片段依然沒有完全轉化成NH3。作者們認為加入的部分石墨鉀沒有與3中的N2片段反應,而被H2O或HCl淬滅。
⑥對比表1中條目3與條目6,在質子化之前,加入過量的石墨鉀則會抑制N2H4的生成。
⑦如表1中條目3所示,H2O作為質子來源,在過量的(100當量)石墨鉀存在下,可以產生最多量的NH3(1.20(19)當量)。
⑧對照實驗:使用表1條目3的反應條件,在14N2氛圍下,使用15N標示的3,結果顯示僅有15NH3生成,進一步說明產物中的N源來自于3中的Ti–N=N–Ti單元。
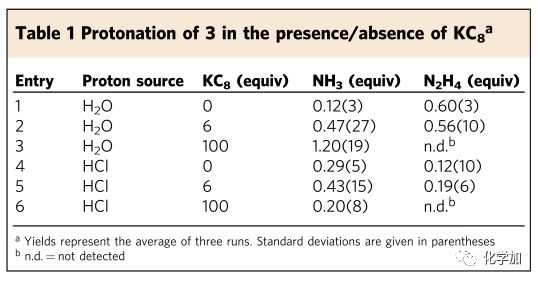
表1. 3與H2O或HCl反應生成的NH3和N2H4數據表
簇合物[3]-的合成與表征。
①如圖2所示的反應過程,氮氣氛圍下,[Mo3S4Ti]簇合物2與6到10當量(比合成3稍過量)的石墨鉀反應,可以得到微量的[3]-。
②核磁共振氫譜表明[3]-為順磁性的,其在氘代四氫呋喃中顯示一個寬化的五甲基環戊二烯(Cp*)的質子信號。
③晶體結構(如圖6所示)顯示,一分子[3]-中有三個鉀原子與橋聯的N2片段作用,其中N=N鍵長(1.293(5) ?)與3中的N=N鍵長(1.294(7) ?)接近。對比[3]-和3的結構,同時也發現[3]-中兩個[Mo3S4Ti]立方體單元間的距離更長。
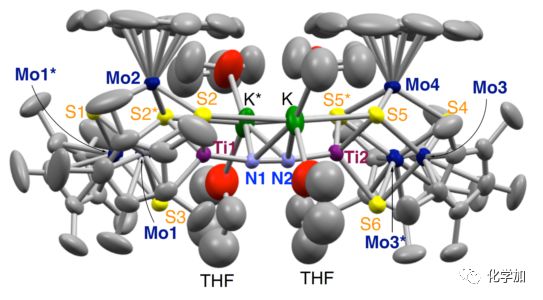
圖6. 簇合物[3]-的晶體結構圖。
小結:作者們合成了一例含N2片段的鉬-鈦-硫簇合物,成功地將N2活化并將其轉化成準化學計量比例的NH3和N2H4。該工作的亮點是,合成的[Mo3S4Ti]立方體單元可以特定地生成鈦基反應位點而促使N2的活化。同時他們的工作為構筑結構和功能接近于的鐵鉬輔因子的金屬硫簇合物做出了重要的參考。
文獻鏈接:Y. Ohki*, K. Uchida, M. Tada, R. E. Cramer, T. Ogura, T. Ohta, N2 Activation on a Molybdenum–Titanium–Sulfur Cluster. Nat. Commun. 2018, 9, 3200. (DOI: 10.1038/s41467-018-05630-6) https://www.nature.com/articles/s41467-018-05630-6
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn