

(圖片來源:J. Am. Chem. Soc.)
正文
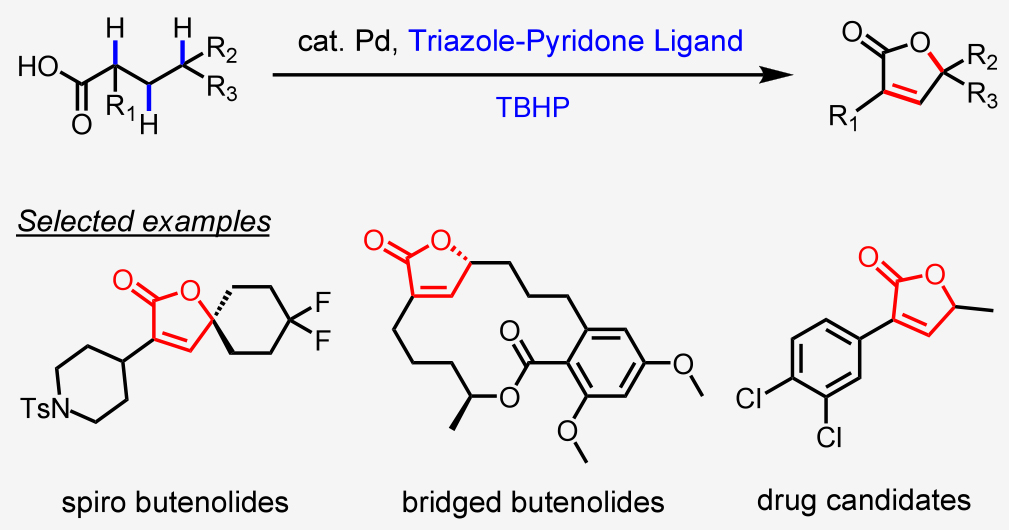
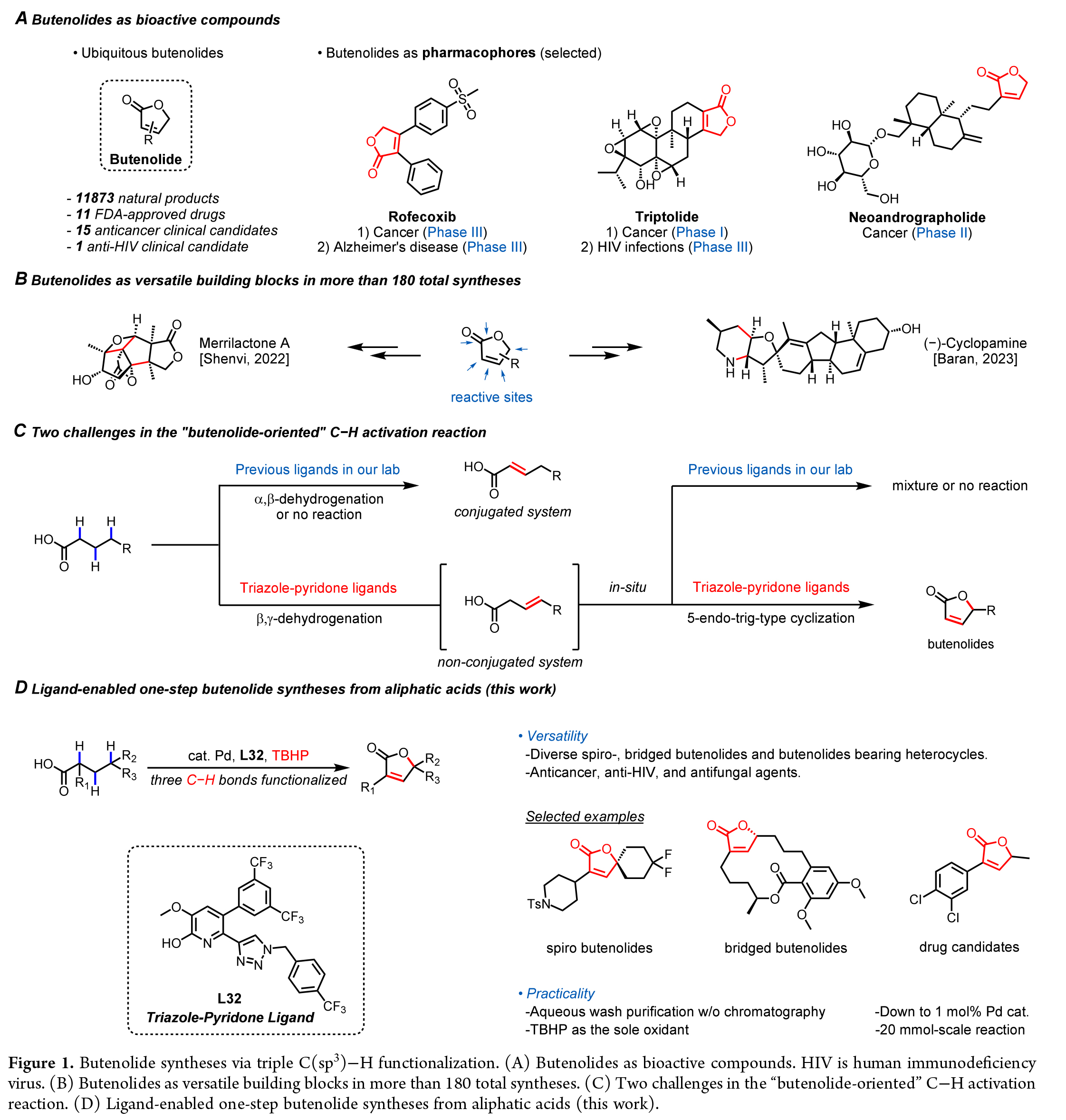
在過去十年里,盡管通過C-H活化構建單鍵方面已經取得了顯著進展,但直接從大宗化學品一步構建重要分子骨架(即結構導向的C-H活化)仍是一個重大挑戰。由于大宗化學品通常僅含有一個官能團,因此在構建高度官能團化的分子骨架時,往往需要經歷多次C(sp3)-H官能團化。丁烯酸內酯作為一種經典的藥效團和多功能合成中間體,已受到制藥行業和合成化學家的廣泛關注。近日,美國斯克里普斯研究所余金權課題開發了一種含三唑-吡啶酮配體的鈀催化劑,其可同時實現脂肪酸的亞甲基和次甲基C-H鍵活化,通過三重官能團化實現了一系列丁烯酸內酯的合成(Figure 1)。歡迎下載化學加APP到手機桌面,合成化學產業資源聚合服務平臺。
(圖片來源:J. Am. Chem. Soc.)
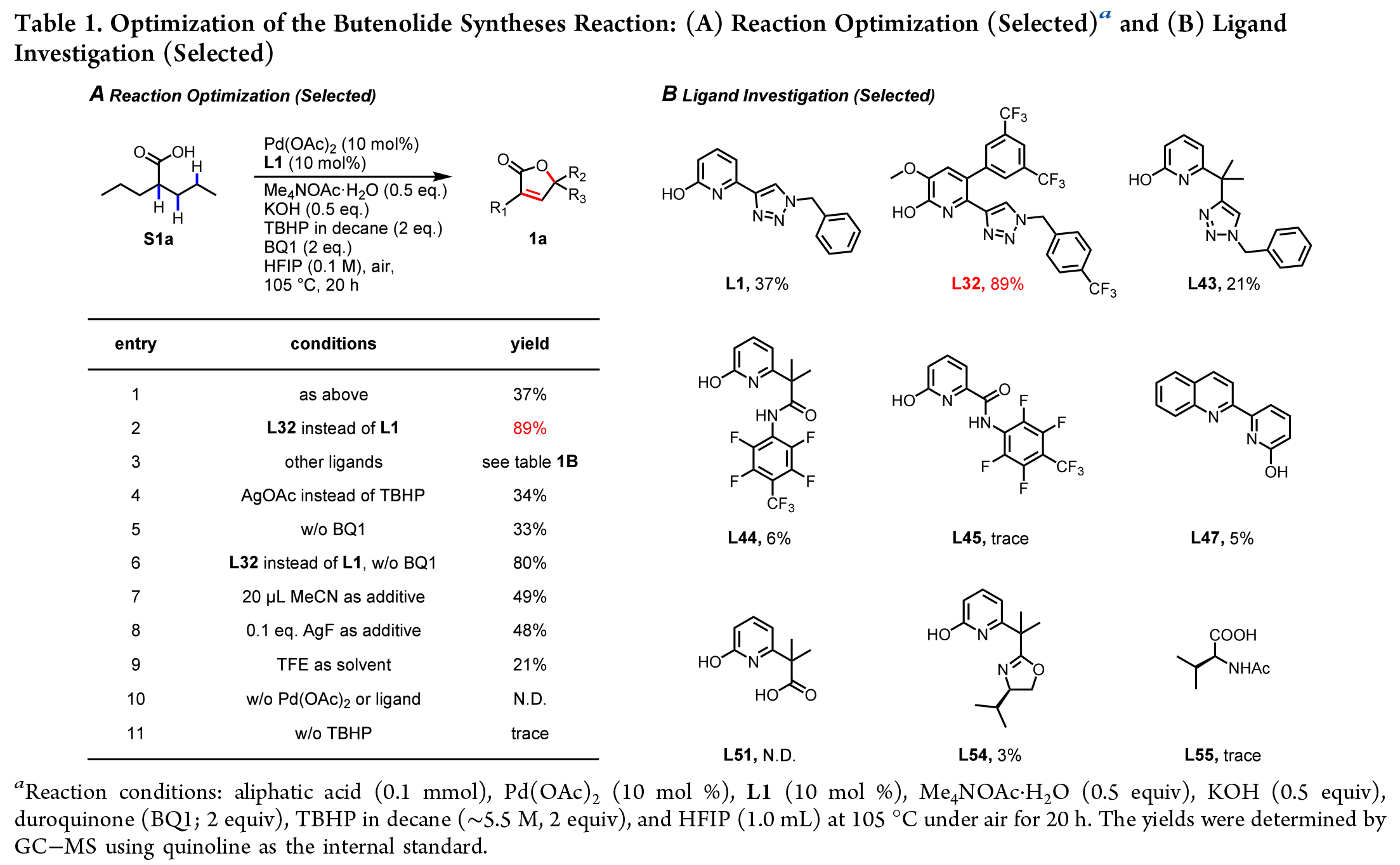
首先,作者使用脂肪酸S1a作為模板底物對此轉化進行了探索(Table 1)。通過一系列條件篩選,作者發現當使用S1a (0.1 mmol), Pd(OAc)2 (10 mol%), L32 (10 mol%), Me4NOAc·H2O(0.83 equiv),KOH(0.17 equiv), MeCN (20 μL), BQ1 (1 equiv), TBHP in decane (~5.5 M, 3 equiv), HFIP(0.8 mL), 在空氣氛圍下105 °C反應20 h可以以89%的產率得到丁烯酸內酯產物1a。
(圖片來源:J. Am. Chem. Soc.)
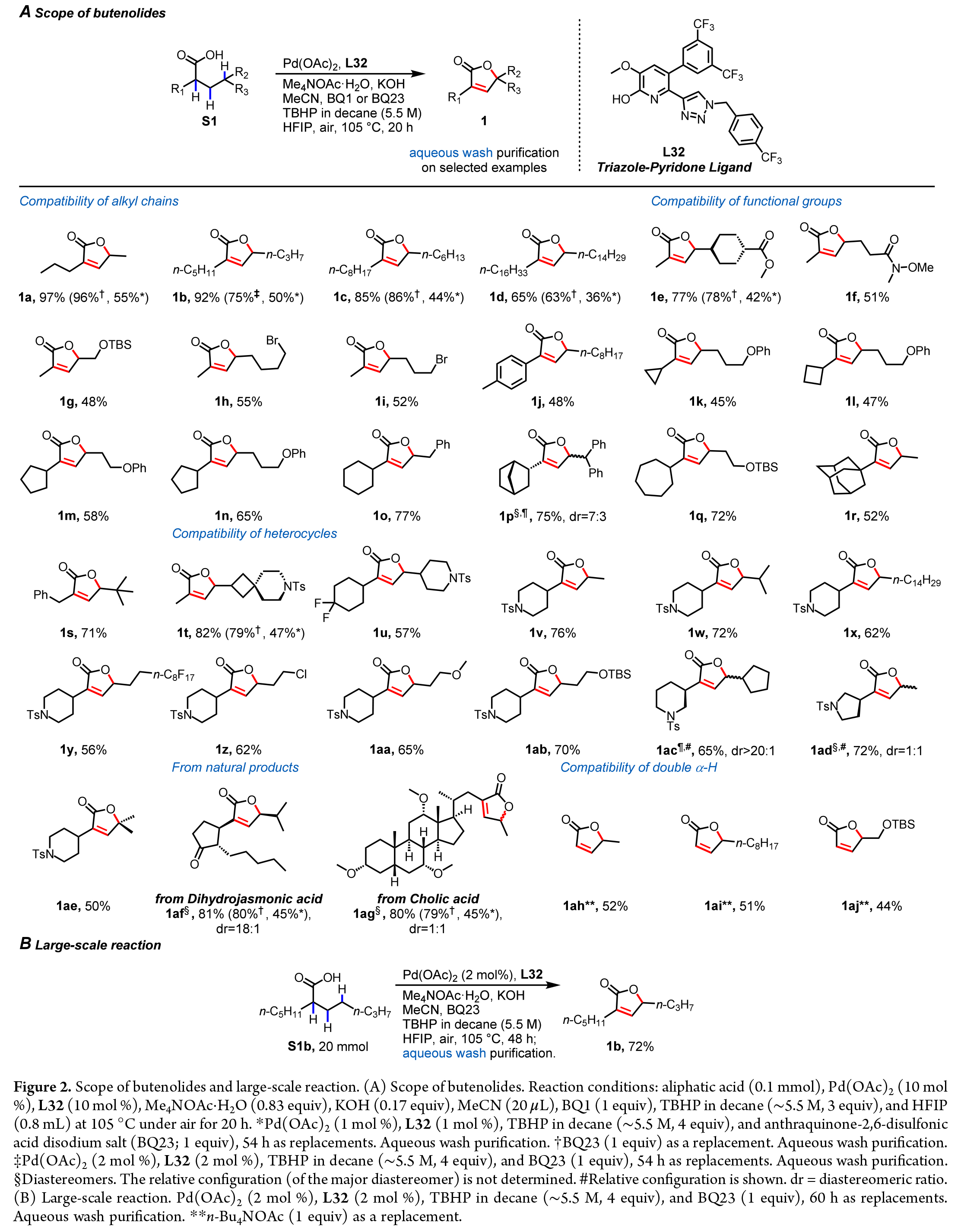
在得到了最優反應條件后,作者對此轉化的底物范圍進行了考察(Figure2a)。實驗結果表明,一系列不同取代的脂肪酸均可順利兼容此轉化,以44-97%的產率得到相應的產物1a-1z, 1aa-1aj。值得注意的是,生物活性分子dihydrojasmonic acid和cholic acid等均可兼容,證明了此轉化的實用性。
為了驗證該反應在放大規模下的適用性,作者以S1b為底物,在20 mmol的反應規模下進行了嘗試。當使用2 mol%的催化劑,并加入水溶性添加劑時,僅通過簡單的水洗純化步驟,在無需色譜分離的條件下即可以72%的產率得到丁烯酸內酯產物1b(Figure2b)。在相同條件下進行的0.1 mmol規模反應也可以以75%的產率獲得產物1b?,進一步證明了該方法的可擴展性。
(圖片來源:J. Am. Chem. Soc.)
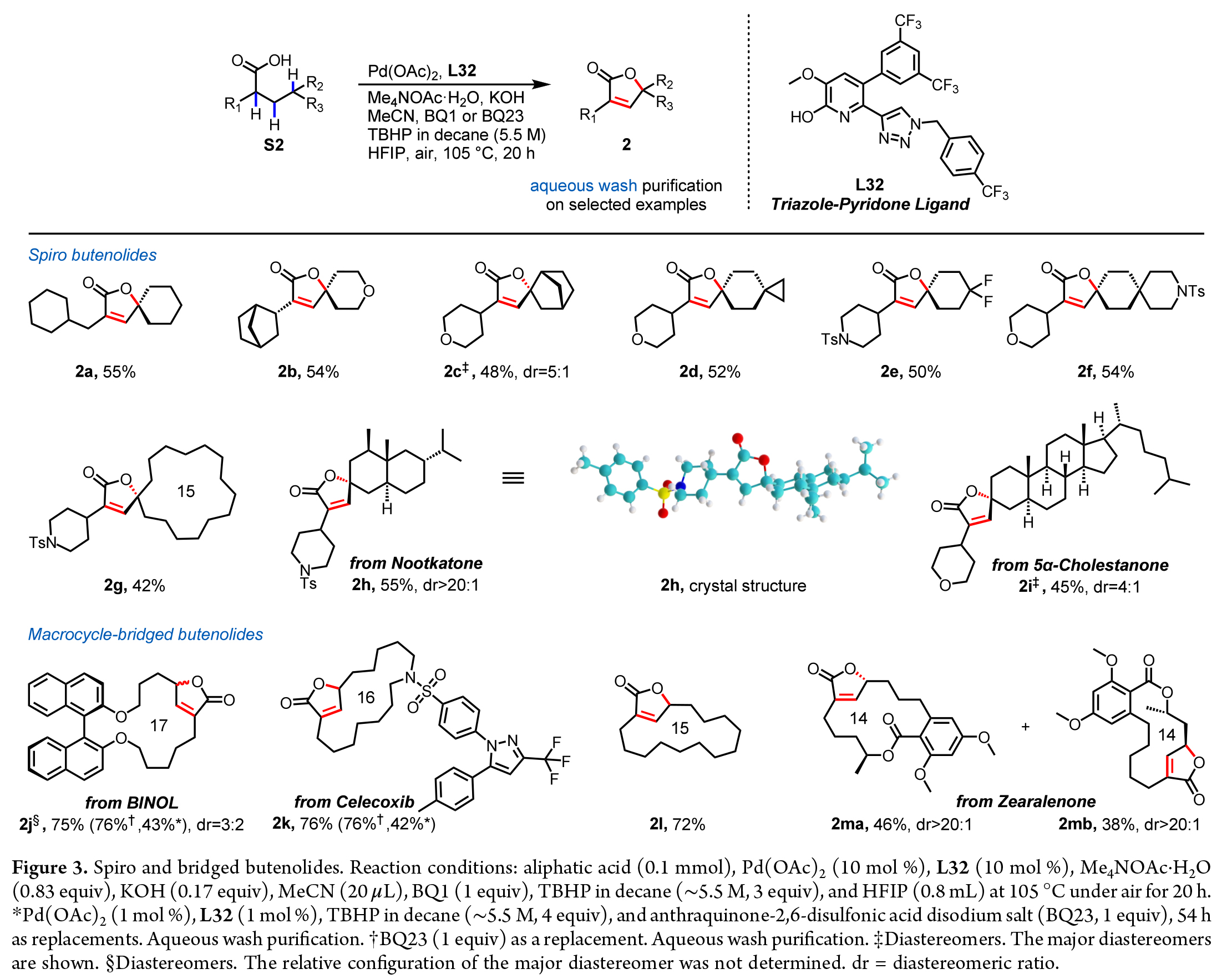
螺環丁烯酸內酯廣泛存在于具有多種生物活性的天然產物中。作者發現,通過該方法可以以42-55%的產率合成出不同螺環大小的多種螺環丁烯酸內酯,包括五元環(2c)、六元環(2a-2f, 2h和2i)以及大環(2g)。此外,作者還成功合成了含有雜環的螺環丁烯酸內酯,如吡喃環(2b-2d, 2f和2i)和哌啶環(2e-2h)。源自天然產物nootkatone(S2h)和5α-膽甾烷酮(S2i)的底物也被成功轉化為具有擁擠且復雜三維結構的螺環丁烯酸內酯。且產物2h的結構通過單晶X射線衍射分析得到了確認(Figure3)。
橋環丁烯酸內酯是另一類具有重要生物活性的天然產物。令人欣喜的是,作者所發展的三重C-H官能團化反應可成功應用于14-17元大環羧酸,以72-84%的產率得到相應的橋環丁烯酸內酯2j-2m。而11元十一烷羧酸因環張力較大,僅以15%的NMR產率獲得產物。以BINOL衍生的底物為原料,可得到一對同時具有軸手性和中心手性的橋環丁烯酸內酯(dr = 3:2)。此外,連有塞來昔布的復雜環狀羧酸(S2k)也表現出良好的兼容性,產率為76%。值得注意的是,大環羧酸上的手性中心能通過遠程(2ma)或鄰近(2mb)的手性誘導,在丁烯酸內酯形成過程中表現出高度的非對映選擇性。此外,該方法還能耐受環系中存在的雜原子(2j, 2k, 2m)、芳香環(2j, 2m)和酯基(2m)。
(圖片來源:J. Am. Chem. Soc.)
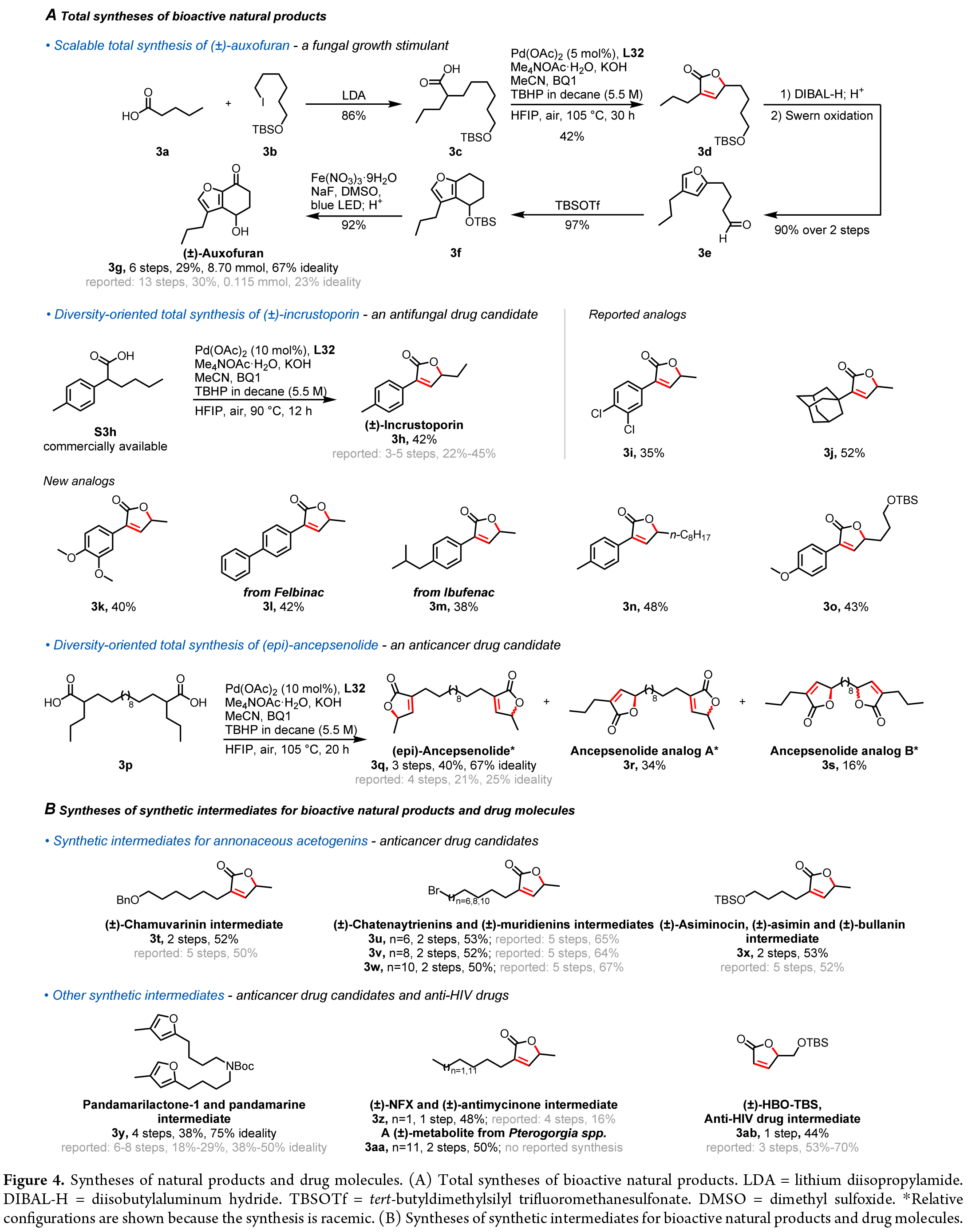
在現代合成化學中,實現生物活性化合物的高效、可擴展合成是研究的重要目標。作者利用所發展的C-H活化過程可成功實現Auxofuran、Incrustoporin、Ancepsenolide等多個生物活性天然產物和藥物分子的合成(Figure4)。
此外,丁烯酸內酯作為關鍵中間體廣泛存在于多種天然產物和藥物分子中。作者利用三重C-H官能團化反應,從市售脂肪酸出發高效合成了一系列關鍵中間體,用于優化藥物類似物并開發藥物候選物。此外,該方法還成功應用于合成抗麻風和抗癲癇活性的生物堿中間體、抗真菌和抗癌代謝物的前體,以及HIV治療核苷類似物的重要中間體。總體而言,該方法具有高效率、可擴展性、可獲得多種類似物等優勢,為藥物化學和天然產物合成提供了強有力的工具。
(圖片來源:J. Am. Chem. Soc.)
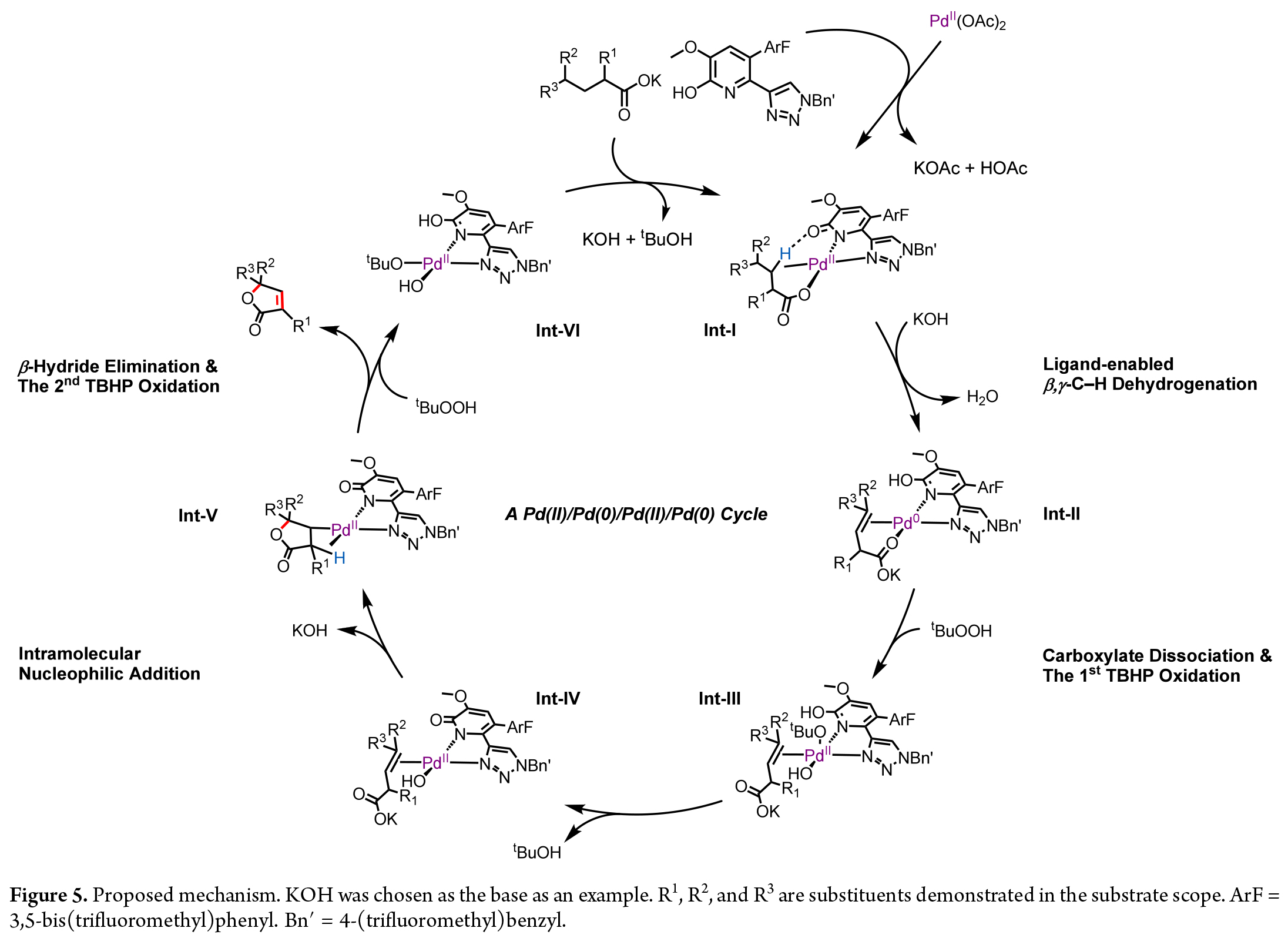
作者通過控制實驗得出反應中β,γ-不飽和酸是可能的反應中間體。因此,作者提出了一個Pd(II)/Pd(0)/Pd(II)/Pd(0)催化循環來解釋丁烯酸內酯的一步形成過程(Figure5)。反應首先通過配體促進的β,γ-脫氫作用生成Pd(0)物種,隨后在TBHP的作用下被氧化為Pd(II)物種。接下來,Pd(II)催化羧酸根對雙鍵進行親核環化,形成在β位帶有C–Pd鍵的內酯。最后,通過位點選擇性的β-氫消除生成丁烯酸內酯產物,并再生Pd(0)物種。Pd(0)可以在TBHP作用下再次被氧化為Pd(II),從而完成催化循環。由于BQ對產率的提升作用很小,它在反應中不太可能是氧化劑。相反,BQ可能通過配位到Pd(0)來防止鈀黑的形成,這可以由反應中未檢測到對苯二酚的生成而得到證實。
(圖片來源:J. Am. Chem. Soc.)
總結
余金權課題組通過利用新開發的三唑-吡啶酮配體,成功通過三重C-H官能團化反應實現了多種丁烯酸內酯的合成。該反應可兼容多種C(sp3)-H鍵,可靈活構建α和γ位取代的丁烯酸內酯。其中包括螺環丁烯酸內酯、橋環丁烯酸內酯以及含雜環的丁烯內酯等均可通過此方法高效制備。利用該方法,作者完成了12種生物活性天然產物和藥物分子的全合成或形式合成。
聲明:化學加刊發或者轉載此文只是出于傳遞、分享更多信息之目的,并不意味認同其觀點或證實其描述。若有來源標注錯誤或侵犯了您的合法權益,請作者持權屬證明與本網聯系,我們將及時更正、刪除,謝謝。 電話:18676881059,郵箱:gongjian@huaxuejia.cn